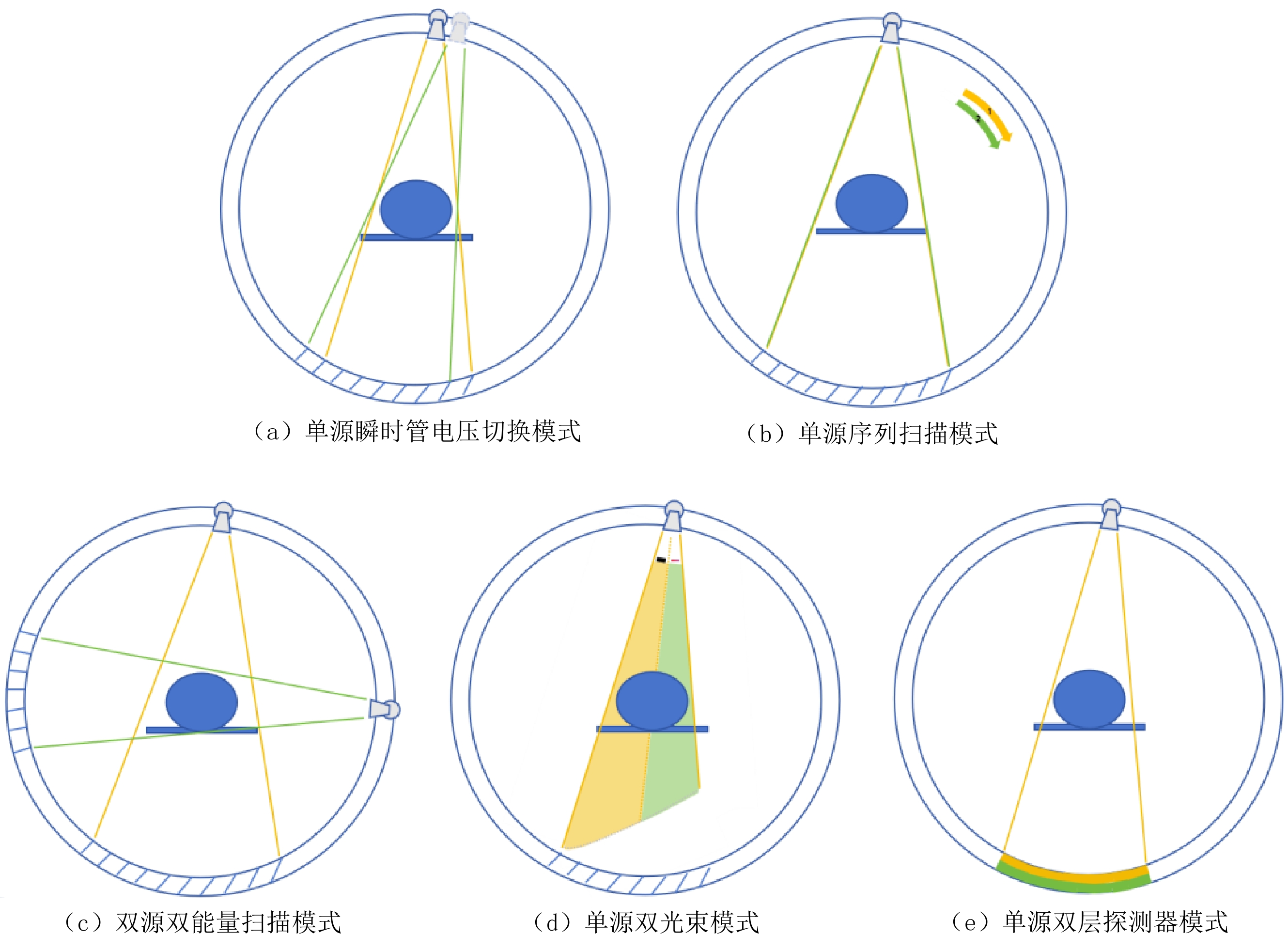
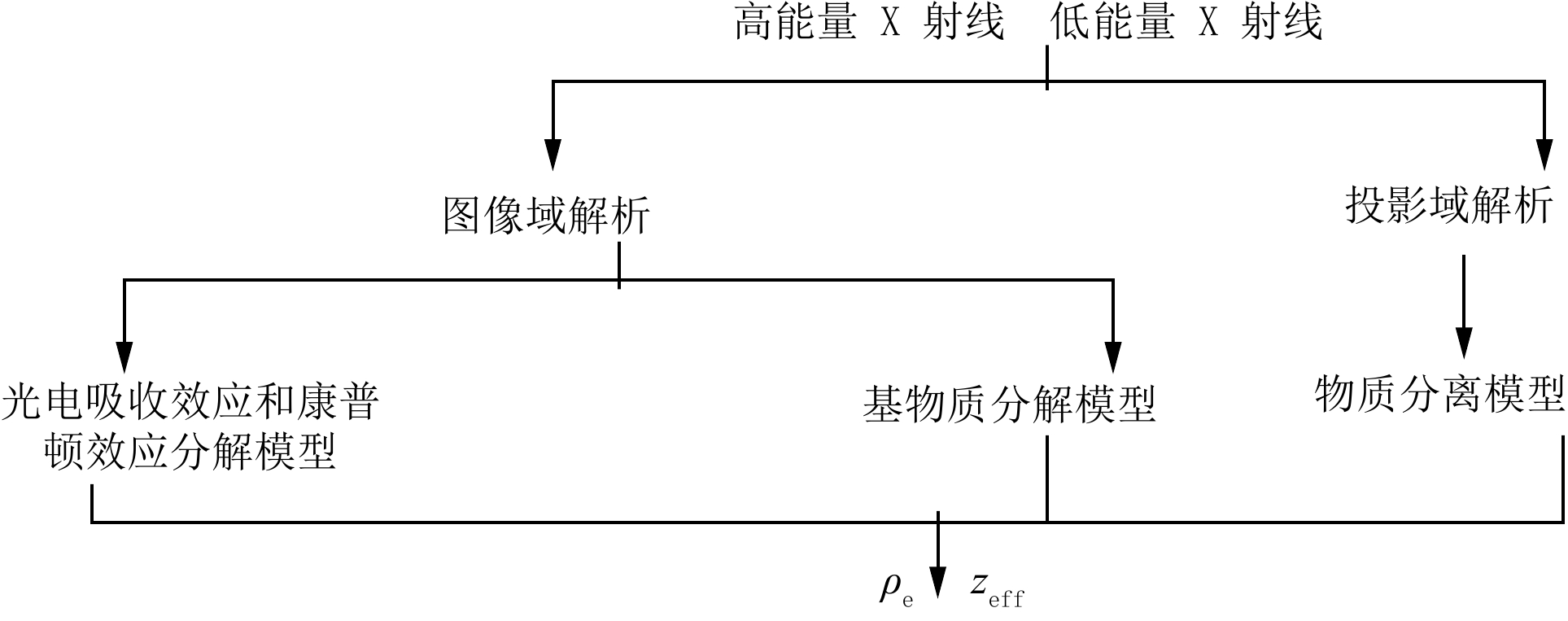
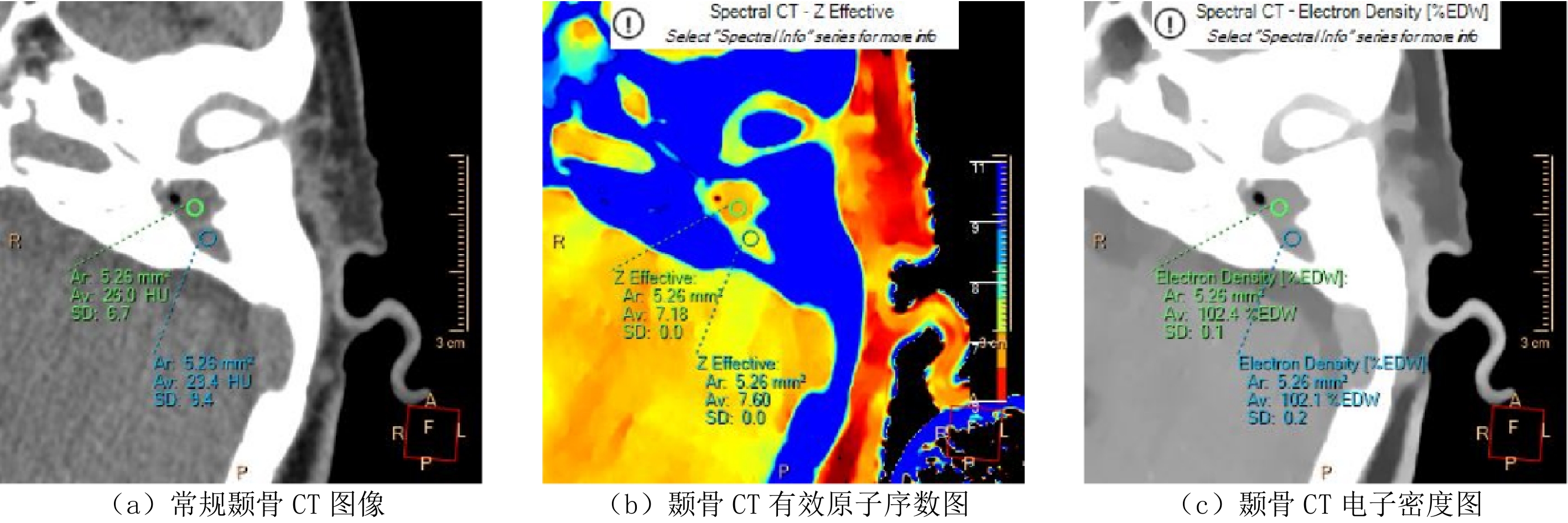
Advances in Measurements of Electron Density and Effective Atomic Number Using Dual-energy Computed Tomography
-
摘要:
在双能量CT多参数功能分析中,电子密度和有效原子序数的精确测量是实现精准影像诊断和辐射剂量估算的基础。本文综述不同双能量成像模式CT在测量电子密度和有效原子序数准确性方面的研究进展,旨在为影像诊断和治疗计划的研究和临床应用提供参考。
Abstract:Accurate measurements of electron density and effective atomic number are essential for precise imaging diagnosis and dose estimation in the multiparametric functional analysis of dual-energy computed tomography (CT). This paper provides a review of research progress pertaining to different dual-energy imaging modalities of CT for measuring electron density and effective atomic number accurately. Its aim is to offer a reference for improving the accuracy of imaging diagnosis and treatment planning.
-
Keywords:
- dual-energy CT /
- electron density /
- effective atomic number /
- phantom
-
在我国和世界其他国家,肺癌是恶性肿瘤中发病率和死亡率较高的一种[1−2]。非小细胞肺癌(non-small cell lung cancer,NSCLC)约占肺癌总患者数的80%[3]。早期肺癌可选择外科手术根治性切除,而晚期肺癌则使用综合治疗、全身治疗等手段,5年生存率仅在20%左右[4]。精准的分期对肺癌治疗方法的选择、预后评估至关重要[5]。CT是目前肺癌诊断、分期、疗效评价和随诊的主要影像学检查手段。影像组学技术可以进一步评估肿瘤的异质性,辅助评价肺癌疗效、预后生存、预测病理结果等[6−8]。目前应用肿瘤影像组学来预测肺癌分期的研究还比较少。
因此,本研究尝试开发一种基于影像组学的机器学习分类模型,用来对肺癌分期进行预测,并探讨其预测效能。
1. 材料与方法
1.1 研究对象
本研究部分数据来自癌症影像公共数据库(the cancer imaging archive,TCIA)里面NSCLC-Radiomics项目中的数据集lung 1,该数据集内容包括NSCLC患者CT影像资料以及年龄、性别、TNM分期、病理结果等重要临床信息,选用其内291例符合要求的病例资料。另一部分数据来源于本院2021年1月至2022年12月,经病理证实的91例NSCLC患者的CT影像及临床资料。
纳入标准:①经病理证实为NSCLC,有完整胸部CT影像资料和相关临床信息;①病灶为肺内单发肿瘤,最大径≥10 mm;③整个肿瘤包含在扫描范围内。排除标准:①术前进行放射治疗及(或)化学治疗;②肺部有基础肺疾病,如慢阻肺、支扩、结核等;③存在阻塞性肺炎或阻塞性肺不张等并发症。
本研究把肺癌患者根据分期划分为1组(Ⅰ、Ⅱ期)和2组(Ⅲ期、Ⅳ期)。使用公共数据库病例作为训练集,本院的病例作为测试集行外部验证,以保证本研究的可靠性。本研究项目已经医院伦理委员会批准,审批号为K-2023-052。所有患者临床信息见表1。
表 1 训练集和测试集病例的基本临床信息与CT形态学特征(n,%)Table 1. Basic clinical information and CT morphological features of training and testing set cases (n, %)参数 训练集 测试集 1组(n=103) 2组(n=188) $t/\chi^2 $ P 1组(n=20) 2组(n=71) $t/\chi^2 $ P 性别 0.266 0.606 0.268 0.605 男 71(68.932) 124(65.957) 15(75.000) 49(69.014) 女 32(31.068) 64(34.043) 5(25.000) 22(30.986) 年龄/岁 72.649±8.768 66.877±9.698 4.795 <0.001 61.621±9.006 63.662±9.601 0.851 0.401 病灶大小/mm 37.896±20.348 45.393±21.492 −2.889 0.004 39.036±19.868 50.345±21.325 −2.102 0.038 病理类型 25.235 <0.001 5.465 0.141 腺癌 16(15.534) 19(10.106) 1(5.000) 9(12.676) 鳞癌 32(31.068) 70(37.234) 6(30.000) 18(25.352) 大细胞癌 17(16.505) 70(37.234) 2(10.000) 21(29.577) 未分类 38(36.893) 29(15.426) 11(55.000) 23(32.394) 深分叶征 0.02 0.888 0.317 0.573 无 55(53.398) 102(54.255) 11(55.000) 44(61.972) 有 48(46.602) 86(45.745) 9(45.000) 27(38.028) 胸膜凹陷征 0.353 0.552 2.887 0.089 无 56(54.369) 109(57.979) 11(55.000) 53(74.648) 有 47(45.631) 79(42.021) 9(45.000) 18(25.352) 毛刺征 0.033 0.856 0.846 0.358 无 52(50.485) 97(51.596) 11(55.000) 47(66.197) 有 51(49.515) 91(48.404) 9(45.000) 24(33.803) 棘状突起 0.238 0.626 1.141 0.285 无 38(36.893) 64(34.043) 8(40.000) 38(53.521) 有 65(63.107) 124(65.957) 12(60.000) 33(46.479) 支气管气相 0.042 0.837 3.613 0.057 无 96(93.204) 174(92.553) 18(90.000) 70(98.592) 有 7(6.796) 14(7.447) 2(10.000) 1(1.408) 空洞 0.421 0.516 1.501 0.221 无 91(88.350) 161(85.638) 19(95.000) 60(84.507) 有 12(11.650) 27(14.362) 1(5.000) 11(15.493) 空泡征 0.004 0.947 3.613 0.057 无 94(91.262) 172(91.489) 18(90.000) 70(98.592) 有 9(8.738) 16(8.511) 2(10.000) 1(1.408) 钙化 0.062 0.803 0.936 0.333 无 93(90.291) 168(89.362) 19(95.000) 70(98.592) 有 10(9.709) 20(10.638) 1(5.000) 1(1.408) 1.2 CT检查方法
公共数据集患者CT影像图像矩阵为512×512,层厚3 mm。本院患者的CT扫描采用机型为GE Discovery 750宝石能谱CT,矩阵为512×512,层厚1.25 mm,管电压120 kV,管电流使用自动调节技术进行控制,患者采取仰卧位,双手抱头,头先进,深吸气后屏气进行扫描。CT图像重建法都是软组织算法。
1.3 病灶分割与特征提取
本研究应用3D slicer医学图像处理软件(版本5.0.3,http://www.slicer.org)在CT图像上分割肿瘤病灶并提取图像特征。把CT影像数据导入3D Slicer软件,先由1名具有8年放射诊断经验的医师观察病灶横断面图像,在病灶最大横断面和其上、下各1个层面,共3个层面分别勾划病灶的边界,采用三维半自动分割辅助处理,再对勾划的感兴趣区(ROI)逐层进行人工调整,把与病灶紧邻的血管、支气管剔除在感兴趣区轮廓之外,最后请1名具有18年放射诊断经验的医师复核并修改ROI的边缘轮廓(图1)。图像预处理步骤包括像素大小归一化以及重采样等,需要先把体素归一化到1 mm×1 mm×1 mm,以减少图像采集异质性产生的影响,然后提取病灶的影像组学特征。每个肿瘤病灶提取
1037 个影像组学特征,其中14个形状特征、162个一阶直方图特征、861个纹理特征。1.4 CT形态学特征评估
本研究病例CT影像资料由2名医师(放射诊断工作经验分别为8年和18年)在窗宽
1400 HU,窗位−500 HU的标准肺窗横断面分别进行评估,观察以下内容:病灶最大径长度、深分叶征、胸膜凹陷征、毛刺征、棘状突起、支气管气相、空洞、空泡征、钙化等[9−11]。病灶最大径选取肿瘤横截面最大的长径测量。若对2名医师的评估结果有异议,则再以一名具有23年工作经验的放射诊断医师的评估作为最终结果。1.5 影像组学、CT形态学特征筛选及模型建立
对于病灶所提取的影像组学特征,先用t检验,再用最小绝对收缩和选择算子(least absolute shrinkage and selection operator,LASSO)算法,经过十折交叉验证,随机将整个数据集划分成10个相等的子集,进行10次迭代,每次迭代中,选择不同的子集作为验证集,剩余的9个子集合并作为训练集,计算10次迭代评估指标的平均值综合评估,筛选出具有鉴别意义的特征[12]。CT形态学特征通过单因素分析(卡方检验和t检验)的方法进行筛选。通过筛选后的特征将被用于机器学习分类模型训练。
本研究采用5种机器学习分类器,通过五折交叉验证,随机将整个数据集划分成5个相等的子集,进行5次迭代,每次迭代中,选择不同的子集作为验证集,剩余的4个子集合并作为训练集,计算5次迭代评估指标的平均值作为模型性能的综合评估,建立CT影像组学对NSCLC患者分期的预测模型,并选出最优模型,再进行外部验证,用曲线下面积(area under curve,AUC)来评价最优模型在训练集以及测试集的预测能力。步骤如图2所示。
1.6 统计学分析
使用SPSS 27.0和Python软件进行统计分析。①计量资料(患者年龄和病灶大小)采用独立样本t检验进行组间比较,计数资料(包括患者性别、病理类型以及病灶CT形态学特征)采用卡方检验进行组间比较,此部分使用SPSS 27.0进行分析。②t检验和LASSO算法特征筛选使用Python软件(版本3.9.13)完成。③机器学习分类模型的建立、验证以及受试者工作特征(ROC)曲线绘制使用python软件(版本3.7)完成,这项工作得到了极智分析平台的支持(https://www.xsmartanalysis.com/)。以P<0.05为差异有统计学意义。
2. 结果
2.1 临床信息和CT形态学特征的组间比较
训练集291例患者共291个病灶,1组(Ⅰ、Ⅱ期)有103个,2组(Ⅲ期、Ⅳ期)有188个,患者年龄、肿瘤病灶的大小、病理类型在两组间差异具有统计学意义,病灶的其余指标在两组间差异没有统计学意义。测试集91例患者共91个病灶,肿瘤病灶的大小在两组间差异具有统计学意义,其余指标在两组间差异无统计学意义(表1)。
2.2 影像组学分析
训练集数据集包含病灶291个,用Python软件先进行t检验,再进行LASSO回归,从
1037 个特征里筛选出13个预测NSCLC分期最有价值的影像组学特征,最佳λ值0.0295 (图3 ~ 图5)。13个特征名称、系数见表2,里面包含2个原始形状特征、9个小波纹理特征和2个高斯特征。LASSO回归函数公式:yi=wTxi+b,yi代表预测结果,xi为对应yi的每一个特征数值,w是特征权重系数,常数项b=0.6460 。表 2 影像组学特征筛选结果Table 2. Imaging omics feature screening results影像组学特征 权重系数 original_shape_Flatness − 0.01491 original_shape_Sphericity − 0.04153 wavelet-LLH_firstorder_Mean 0.026735 wavelet-LLH_glcm_Imc1 0.022442 wavelet-LHH_glcm_ClusterShade − 0.04337 wavelet-LHH_glszm_SmallAreaLowGrayLevelEmphasis − 0.01344 wavelet-HLH_firstorder_Skewness − 0.01968 wavelet-HHL_gldm_DependenceVariance − 0.00985 wavelet-HHH_firstorder_Skewness 0.003253 wavelet-HHH_glcm_Imc2 − 0.05804 wavelet-LLL_gldm_DependenceEntropy − 0.03631 log-sigma-2-0-mm-3D_firstorder_Maximum 0.057039 log-sigma-3-0-mm-3D_firstorder_Minimum 0.006818 2.3 机器学习分类模型建立及验证
将筛选出的13个影像组学特征纳入机器学习分类模型训练。本研究采用Logistic回归、随机森林、高斯朴素贝叶斯、支持向量机、AdaBoost等5种机器学习模型分类器,用重采样训练/验证机制,建立CT影像组学对肺癌分期的预测模型。用曲线下面积(area under curve,AUC)对上述5种模型在训练集和验证集的预测能力进行评价,并计算出敏感度、特异度等指标(表3和表4),ROC曲线结果见图6和图7。用不同模型进行训练和验证时,采用随机森林预测模型极表现最佳,在所有模型中,运用此模型的验证集AUC值最高,为0.740,敏感度和特异度分别为0.666和0.740,也处于较高水平。最后用测试集数据对随机森林预测模型进行外部验证,ROC曲线结果见图8,并计算出敏感度、特异度等指标(表5)。该模型在测试集AUC值为0.698,敏感度为0.873,特异度为0.500。
表 3 5种机器学习分类模型-训练集结果Table 3. 5 Machine learning classification models - training set results分类模型 AUC(95%CI) cutoff 准确率 灵敏度 特异度 阳性预测值 阴性预测值 logistic 0.712 (0.639-0.786) 0.654 0.668 0.643 0.722 0.805 0.534 Random Forest 1.000 (NaN-NaN) 0.620 0.988 0.998 1.000 1.000 0.968 GNB 0.778 (0.711-0.844) 0.692 0.738 0.741 0.744 0.836 0.616 SVM 0.657 (0.577-0.738) 0.665 0.621 0.588 0.694 0.785 0.477 AdaBoost 0.997 (0.994-1.000) 0.503 0.973 0.973 0.989 0.994 0.940 注:Logistic为逻辑回归;Random Forest为随机森林;GNB为高斯朴素贝叶斯;SVM为支持向量机;AdaBoost为自适应提升算法。 表 4 5种机器学习分类模型-内部验证集结果Table 4. 5 machine learning classification models - internal validation set results分类模型 AUC(95%CI) cutoff 准确率 灵敏度 特异度 阳性预测值 阴性预测值 logistic 0.697 (0.579-0.816) 0.654 0.666 0.684 0.738 0.809 0.513 Random Forest 0.740 (0.634-0.845) 0.620 0.648 0.666 0.740 0.779 0.519 GNB 0.668 (0.544-0.791) 0.692 0.632 0.684 0.661 0.774 0.461 SVM 0.629 (0.505-0.753) 0.665 0.600 0.678 0.612 0.752 0.470 AdaBoost 0.616 (0.488-0.744) 0.503 0.605 0.692 0.567 0.706 0.458 表 5 随机森林预测模型的外部验证结果Table 5. External validation results of the Random Forest prediction model组别 AUC(95%CI) cutoff 准确率 敏感度 特异度 阳性预测值 阴性预测值 训练集 1.000(NaN-NaN) 0.600 0.991 1.000 1.000 1.000 0.974 测试集 0.698(0.556-0.840) 0.600 0.593 0.873 0.500 0.870 0.311 3. 讨论
NSCLC患者治疗方式的选择主要是根据肿瘤的TNM分期。Ⅰ、Ⅱ期患者优先选择外科手术根治性切除。Ⅲ期肿瘤的异质性明显,分为不可切除和以外科为主的综合治疗。Ⅳ期患者需要全身治疗。可见肿瘤的精准分期在选择临床治疗手段方面具有重要作用[13]。目前临床上主要通过CT检查,观察病灶大小、侵犯周围组织及转移等情况来判断肺癌患者的分期[14],但是单一检查指标在临床诊断上可能有一定局限性,已有研究[15−18]发现增加检测指标能够弥补这方面的不足,例如血清学指标CYFRA21-1、NSE、CEA等与肺癌的分期、病理等有关,联合检测这些指标有望提升肺癌预后预测价值。我们猜想,通过从CT图像提取的影像组学特征可以反映肿瘤的异质性,可能对肺癌的分期、甚至预后有一定预测价值,目前这方面的研究还是比较少的。由于Ⅰ、Ⅱ期与Ⅲ、Ⅳ期这两类患者的治疗与随访方案存在较大差异,本研究以此为节点,将数据集内患者分为两组,通过对两组患者肿瘤CT形态学特征评估,利用影像组学方法对肿瘤异质性进行深入分析,拟开发一个稳定可靠的多中心病例数据的机器学习分类预测模型,并探讨此模型对NSCLC患者分期的预测价值。
本研究病例的CT形态学特征里面,除了病灶大小之外,其它特征在不同分期患者的差异无统计学意义,可能是由于肺癌CT形态学特征与肿瘤病理基础密切相关,用于鉴别肺癌与其它肺内病变,但是随着肿瘤分期的进展,肺癌除大小变化外,其它形态特征变化差异不大。同时,本组病例中,包含一部分中央型肺癌患者,可能对CT形态学特征的判读有一定影响。
CT影像组学不同于肿瘤的CT形态学特征,它通过计算机提取、分析CT影像的形状、纹理等高维特征信息,可更深入地研究病灶,间接反映其异质性,采用相应算法建立预测模型,可达到疾病诊断分级、基因表达评估、预后定量分析的目的[19−21]。本研究在特征筛选后,得到13个具有较高诊断价值的影像组学特征用于后续建立NSCLC患者分期预测模型。其中权重系数最大的是灰度共生矩阵中的信息相关度wavelet-HHH_glcm_Imc2,其次是一阶统计特征最大灰度值log-sigma-2-0-mm-3D_firstorder_Maximum。灰度共生矩阵是体素对的呈现,是强度和形状的组合,信息相关度包含熵的概念,在系数计算相关度中包含分布的丰富值来衡量画面纹理的粗糙程度,也就是利用体素对熵的计算来量化纹理的复杂程度。熵是异质性的度量,可以通过测量体素区域的熵来反映影像区域的丰富程度和肿瘤的异质性[22−23]。通常预后比较差的肿瘤内部的异质性较明显,其CT影像图像体素的分布更丰富、纹理更复杂。最大灰度值通过计算肿瘤病灶区域影像的灰度值获得,它与肿瘤内灰度强度的分布状况有关,能反映出肿瘤内部的异质性[24−25]。
目前尚未有学者开发类似的影像组学模型用于预测NSCLC的分期。本研究选取公共数据库中的291例患者数据,采用Logistic回归、随机森林、高斯朴素贝叶斯、支持向量机、AdaBoost等5种机器学习分类器训练并选出最优模型,为确保模型的可重复性与稳定性,将本院的91例肺癌患者数据作为测试集进行外部验证该模型的预测效能。在5种模型中,使用随机森林模型的验证集准确率和AUC值均为最高,是本研究的最优模型。随机森林模型以决策树作为元分类器,引入了随机性以增加模型的多样性,能够有效地处理高维数据,同时不受共线性影响,在数据分析中具备临床应用价值[26]。该预测模型在训练集的AUC为1.000,表示模型具有很好的区分能力;在验证集的AUC为0.740,在测试集的AUC为0.698,提示该模型具有一定的区分能力,但还有改进的空间;可能是由于病例数据的不平衡,也可能是模型本身的局限性,在训练集中拟合度较高,在未知的数据上性能下降。我们将继续增加病例数,规范扫描方案,不断优化特征选择技术、调整模型参数,以提高模型的预测能力。
本研究的不足之处:①所使用的病例较少,用于模型训练的病例CT扫描层厚较厚,可能会导致数据不平衡,对机器学习分类模型结果有一定影响。②研究数据信息量有限,仅包含CT图像、基本临床信息、病理类型等,缺少其它相关信息,如肿瘤分化程度、血清肿瘤标志物等。③本研究数据包含部分中央型肺癌病例,可能影响CT形态学特征的判读。在后续的工作中,我们还需要收集更多病例,并对分期进行细分,建立CT影像组学预测NSCLC分期的多分类模型,深入验证本研究的结论。
4. 结论
综上所述,本研究通过提取和筛选肿瘤的影像组学特征,开发并验证了一种基于影像组学特征预测NSCLC患者分期的机器学习分类模型,稳定性较好,有一定预测能力,在临床分期诊断上可提供一定证据支持,有望给临床医生选择治疗策略时增强信心。
-
-
[1] AGOSTINI A, BORGHERESI A, MARI A, et al. Dual-energy CT: Theoretical principles and clinical applications[J]. La Radiologia Medica, 2019, 124(12): 1281-1295.
[2] PATINO M, PROCHOWSKI A, AGRAWAL M D, et al. Material separation using dual-energy CT: Current and emerging applications[J]. Radiographics, 2016, 36(4): 1087-1105.
[3] WANG A S, HSIEH S S, PELC N J. 双能CT的基本原理、应用和未来展望[J]. CT理论与应用研究, 2012, 21(3): 367−386. (in English). WANG A S, HSIEH S S, PELC N J. A review of dual energy CT: Principles, applications, and future outlook[J]. CT Theory and Applications, 2012, 21(3): 367−386.
[4] OHIRA S, WASHIO H, YAGI M, et al. Estimation of electron density, effective atomic number and stopping power ratio using dual-layer computed tomography for radiotherapy treatment planning[J]. Physica Medica, 2018, 56: 34-40.
[5] ZHAO W, SHEN S, KE T, et al. Clinical value of dual-energy CT for predicting occult metastasis in central neck lymph nodes of papillary thyroid carcinoma[J]. European Radiology, 2024, 34(1): 16-25.
[6] ONISHI S, FUJIOKA C, KAICHI Y, et al. Utility of dual-energy CT for predicting the vascularity of meningiomas[J]. European Journal of Radiology, 2020, 123: 108790.
[7] BHARATI A, RANI MANDAL S, GUPTA A K, et al. Non-invasive characterisation of renal stones using dual energy CT: A method to differentiate calcium stones[J]. Physica Medica, 2022, 101: 158−164.
[8] 赵聪, 刘兰平, 汤良, 等. 双肺电子密度值和放化疗模式与NSCLC放射性肺炎发生相关性[J]. 中华肿瘤防治杂志, 2017, 24(18): 1305−1309. DOI: 10.16073/j.cnki.cjcpt.2017.18.009. ZHAO C, LIU L P, TANG L, et al. Effects of different chemotherapeutic models and double lung electron density value on the occurrence of radiation pneumonia of stage Ⅲ NSCLC[J]. Chinese Journal of Cancer Prevention and Treatment, 2017, 24(18): 1305−1309. DOI: 10.16073/j.cnki.cjcpt.2017.18.009. (in Chinese).
[9] KONIETZKE P, STEENTOFT H H, WAGNER W L, et al. Consolidated lung on contrast-enhanced chest CT: The use of spectral-detector computed tomography parameters in differentiating atelectasis and pneumonia[J]. Heliyon, 2021, 7(5): e07066. DOI: 10.1016/j.heliyon.2021.e07066.
[10] RUTHERFORD R A, PULLAN B R, ISHERWOOD, I. Measurement of effective atomic number and electron density using an EMI scanner[J]. Neuroradiology, 1976, 11(1): 15−21.
[11] LI Z, RAVISHANKAR S, LONG Y, et al. Learned mixed material models for efficient clustering based dual-energy CT image decomposition[C]//2018 IEEE Global Conference on Signal and Information Processing (GlobalSIP). IEEE, 2018: 529-533.
[12] 郭俏, 姚旭峰. 双能CT图像域基材料分解算法的研究进展[J]. CT理论与应用研究, 2023, 32(1): 139−146. DOI: 10.15953/j.ctta.2021.067. GUO Q, YAO X F. Progress of material decomposition algorithms in dual-energy CT imaging[J]. CT Theory and Applications, 2023, 32(1): 139−146. DOI: 10.15953/j.ctta.2021.067. (in Chinese).
[13] BROOKS R A, Di CHIRO G. Beam hardening in X-ray reconstructive tomography[J]. Physics in Medicine & Biology, 1976, 21(3): 390−398.
[14] SCHAEFFER C J, LEON S M, OLGUIN C A, et al. Accuracy and reproducibility of effective atomic number and electron density measurements from sequential dual energy CT[J]. Medical Physics, 2021, 48(7): 3525−3539.
[15] ALMEDIDA I P, SCHYNS L E, ÖLLERS M C, et al. Dual-energy CT quantitative imaging: A comparison study between twin-beam and dual-source CT scanners[J]. Medical Physics, 2017, 44(1): 171-179.
[16] HUA C H, SHAPIRA N, MERCHANT T E, et al. Accuracy of electron density, effective atomic number, and iodine concentration determination with a dual-layer dual-energy computed tomography system[J]. Medical Physics, 2018, 45(6): 2486−2497.
[17] LANDRY G, GAUDREAULT M, Van ELMPT W, et al. Improved dose calculation accuracy for low energy brachytherapy by optimizing dual energy CT imaging protocols for noise reduction using sinogram affirmed iterative reconstruction[J]. Zeitschrift für Medizinische Physik, 2016, 26(1): 75-87.
[18] RGEL A, BIER G, HENNERSDORF F, et al. Image quality of CT angiography of supra-aortic arteries: Comparison between advanced modelled iterative reconstruction (ADMIRE), sinogram affirmed iterative reconstruction (SAFIRE) and filtered back projection (FBP) in one patients' group[J]. Clinical Neuroradiology, 2020, (1). DOI: 10.1007/s00062-018-0740-y.
[19] 徐同江, 王旭, 李艳, 等. IMR、iDose4和FBP三种重建算法在隆鼻整形术CT扫描的应用研究[J]. CT理论与应用研究, 2022, 31(3): 357−364. DOI: 10.15953/j.ctta.2021.072. XU T J, WANG X, LI Y, et al. Application of IMR, iDose4 and FBP reconstruction algorithms in CT scanning of rhinoplasty[J]. CT Theory and Applications, 2022, 31(3): 357−364. DOI: 10.15953/j.ctta.2021.072. (in Chinese).
[20] DE M P, ORIGGI D. New adaptive statistical iterative reconstruction ASiR-V: Assessment of noise performance in comparison to ASiR[J]. Journal of Applied Clinical Medical Physics, 2018, 19(2): 275−286. DOI: 10.1002/acm2.12253.
[21] 田璐, 黄红云, 范杰. 双能CT螺距和迭代重建权重对单能衰减和有效原子序数的影响: 体模研究[J]. 中国医学影像技术, 2023, 39(1): 99−103. DOI: 10.13929/j.issn.1003-3289.2023.01.023. TIAN L, HUANG H Y, FAN J. Impact of pitch and iterative reconstruction weight on monochromatic attenuation and effective atomic number of dual-energy CT: A phantom study[J]. Chinese Journal of Medical Imaging Technology, 2023, 39(1): 99−103. DOI: 10.13929/j.issn.1003-3289.2023.01.023. (in Chinese).
[22] 中华医学会放射学分会, 中国医师协会放射医师分会, 安徽省影像临床医学研究中心. 能量CT临床应用中国专家共识[J]. 中华放射学杂志, 2022, 56(5): 476−487. [23] ALKADHI H, EULER A, MAINTZ D, et al. Spectral imaging: Dual-energy, multi-energy and photon-counting CT[M]. Cham: Springer International Publishing, 2022.
[24] GOODSITT M M, CHRISTODOULOU E G, LARSON S C. Accuracies of the synthesized monochromatic CT numbers and effective atomic numbers obtained with a rapid kVp switching dual energy CT scanner[J]. Medical Physics, 2011, 38(4): 2222−2232. (in Chinese).
[25] KAWAHARA D, OZAWA S, YOKOMACHI K, et al. Synthesized effective atomic numbers for commercially available dual-energy CT[J]. Reports of Practical Oncology & Radiotherapy, 2020, 25(4): 692−697.
[26] OGATA T, UEGUCHI T, YAGI M, et al. Feasibility and accuracy of relative electron density determined by virtual monochromatic CT value subtraction at two different energies using the gemstone spectral imaging[J]. Radiation Oncology, 2013, 8: 83.
[27] TATSUGAMI F, HIGAKI T, KIGUCHI M, et al. Measurement of electron density and effective atomic number by dual-energy scan using a 320-detector computed tomography scanner with raw data-based analysis: A phantom study[J]. Journal of Computer Assisted Tomography, 2014, 38(6): 824−827.
[28] KAWAHARA D, OZAWA S, YOKOMACHI K, et al. Accuracy of the raw-data-based effective atomic numbers and monochromatic CT numbers for contrast medium with a dual-energy CT technique[J]. The British Journal of Radiology, 2018, 91(1082): 20170524.
[29] KAWAHARA D, OZAWA S, TANAKA S, et al. Automatic contrast medium extraction system using electron density data with dual-energy CT[J]. The British Journal of Radiology, 2018, 91(1090): 20180396.
[30] MCCOLLOUGH C H, LENG S, YU L, et al. Dual- and multi-energy CT: Principles, technical approaches, and clinical applications[J]. Radiology, 2015, 276(3): 637−653.
[31] 王鹏朝, 单春辉, 郭方凯, 等. 不同双能量组合对Rho/Z检测准确性的模体研究[J]. 中国医疗设备, 2021. DOI: 10.3969/j.issn.1674-1633.2021.09.016. WANG P C, SHAN C H, GUO F K, et al. Phantom study on the accuracy of Rho/Z detection with different dual energy combinations[J]. China Medical Devices, 2021. DOI:10.3969/j.issn.1674-1633.2021.09.016(in Chinese).
[32] LANDRY G, RENIERS B, GRANTON P V, et al. Extracting atomic numbers and electron densities from a dual source dual energy CT scanner: Experiments and a simulation model[J]. Radiotherapy and Oncology, 2011, 100(3): 375−379.
[33] LANDRY G, DORRINGER F, SI-MOHAMED S, et al. Technical note: Relative proton stopping power estimation from virtual monoenergetic images reconstructed from dual-layer computed tomography[J]. Medical Physics, 2019, 46(4): 1821−1828.
[34] YANG M, WOHLFAHRT P, SHEN C, et al. Dual- and multi-energy CT for particle stopping-power estimation: Current state, challenges and potential[J]. Physics in Medicine & Biology, 2023, 68(4). DOI: 10.1088/1361-6560/acabfa.



 下载:
下载: