Evaluation of WHO/ISUP Pathological Grading of Clear Cell Renal Cell Carcinoma by CT-based Extracellular Volume Fraction
-
摘要:
目的:探讨基于CT的细胞外容积分数(ECV)术前评价透明细胞肾细胞癌(ccRCC)WHO/ISUP病理分级的价值。方法:回顾性收集我院收治经手术后病理组织学证实的67例ccRCC患者,患者术前均行腹部CT平扫+三期增强扫描,根据WHO/ISUP分级,将Ⅰ、Ⅱ级纳为低级别组(48例),Ⅲ、Ⅳ级纳为高级别组(19 例)。采集两组患者的一般临床资料,测量计算定量参数,包括延迟期主动脉净增值(∆HUAorta)、延迟期肿瘤净增值(∆HUtumor)及ECV,并进行对比分析,通过绘制ROC曲线评价ECV 对ccRCC病理分级的诊断效能。结果:低级别组ccRCC的∆HUtumor及ECV均高于高级别组。ROC曲线显示,ECV评价WHO/ISUP低级别ccRCC的效能(AUC:0.834)高于∆HUtumor(AUC:0.725)。结论:基于CT的ECV术前评价ccRCC的病理分级具有一定的价值。
-
关键词:
- 计算机断层扫描 /
- 细胞外容积分数 /
- 透明细胞肾细胞癌 /
- WHO/ISUP分级
Abstract:Objective: To investigate the value of computed tomography-based extracellular volume fraction (ECV) for preoperative evaluation of WHO/ISUP pathologic grading of clear cell renal cell carcinoma (ccRCC). Methods: Seventy-two patients with ccRCC who underwent postoperative histological confirmation were retrospectively enrolled. All patients underwent preoperative CT scanning of the abdomen and three-phase enhancement scanning according to the WHO/ISUP grading. Grades I and II were categorized as the low-grade group (48 patients) and grades III and IV were categorized as the high-grade group (19 patients). General clinical data of the two groups were collected, and quantitative parameters, including delayed aortic net value added (∆HUAorta ), delayed tumor net value added (∆HUtumor)and ECV, were measured and compared, and the diagnostic efficacy of ECV in the pathological grading of ccRCC was evaluated by plotting the ROC curve. Results: The ∆HUtumor and ECV of ccRCC in low-grade group were significantly higher than those in high-grade group (P<0.05). The ROC curves demonstrated that the efficiency of ECV in evaluating WHO/ISUP low-grade ccRCC (AUC: 0.834) was higher than that of ∆HUtumor(AUC:0.725). Conclusion: CT-based ECV is valuable for the preoperative evaluation of ccRCC pathological grade.
-
透明细胞肾细胞癌(clear cell renal cell carcinoma, ccRCC)是最常见的肾细胞癌亚型,约占其70%~90%[1],发病率呈逐年上升趋势,恶性程度较其他亚型肾细胞癌更高[2]。2022年第5版WHO肾脏肿瘤分类中明确了世界卫生组织(World Health Organization, WHO)/国际泌尿病理学会(International Society of Urological Pathology, ISUP)病理分级系统适用的肾脏肿瘤类型包括ccRCC[3],因而WHO/ISUP分级也成为判定ccRCC恶性程度与患者预后的标准及重要指标。既往已有ccRCC的CT特征及其定量参数评价WHO/ISUP病理分级的相关性报道,但所得结果差异较大,而将实验室指标结合CT定量参数评价ccRCC病理分级的研究报道较少[4]。基于CT的细胞外容积分数(extracellular volume fraction, ECV)是通过实验室指标结合CT定量参数衍算所得,它是血管内空间分数和细胞外-血管外间隙容积分数之和,能够反映肿瘤微血管密度(microvessel density, MVD)、肿瘤微环境及基质纤维化程度[3],目前已被证实在腹部多种实体肿瘤如肝癌、结直肠癌等病理分级中有一定的诊断价值[5-8],但在ccRCC病理分级方面研究甚少。因而,本研究旨在探讨基于CT的ECV术前评估ccRCC的WHO/ISUP病理分级的诊断价值,为临床制定治疗方案提供更多的依据。
1. 资料与方法
1.1 一般资料
回顾性收集安徽省黄山市人民医院2018年4月至2023年12月间收治经手术后病理组织学证实的67例ccRCC 患者,采集患者的一般资料包括:相关临床症状(腰痛、血尿、腹部包块)、性别、年龄、血细胞比容(hematocrit,HCT)。
纳入标准:①术后病理组织学确诊为ccRCC,并有WHO/ISUP病理分级;②术前均有腹部CT平扫+三期增强扫描;③CT检查与手术间隔<2周;④HCT检测与CT检查间隔≤1周;⑤术前均未行针对ccRCC的治疗。排除标准:①CT扫描期相不全;②图像质量不能满足诊断要求;③排除非ccRCC原因所致HCT减低患者。
1.2 检查方法
使用Siemens Definition AS+64排128层螺旋CT机或GE Optima540 16排CT机行腹部平扫及三期增强扫描。禁食4~6 h进行检查,扫描前30 min内口服清水500 ml左右。扫描范围自膈上至双肾下极水平。扫描参数:管电压为120 kV,管电流为100~260 mA,扫描层厚和层距均为5 mm,螺距0.6,重建层厚1 mm,间距0.8 mm,增强扫描采用高压注射器将非离子型对比剂碘佛醇80~100 ml(1.2 ml/kg)向肘静脉留置针内注入,碘佛醇浓度为320 mgI/mL,注入流率2.5~3.5 ml/s,注射开始后监测膈顶层面腹主动脉内CT值,达100 HU阈值后5~10 s、45~50 s、160 s分别进行动脉期、静脉期、延迟期扫描。
1.3 病理分级
本研究为回顾性研究,所有患者病理结果从病理科报告系统调阅,每份病理报告由两位医师完成,根据不同倍数显微镜下瘤细胞内核仁的观察情况以及核的异形性将ccRCC分为4级,分别为Ⅰ、Ⅱ、Ⅲ、Ⅳ级,再将Ⅰ、Ⅱ级纳为低级别组,Ⅲ、Ⅳ级纳为高级别组。
1.4 图像分析和数据测量
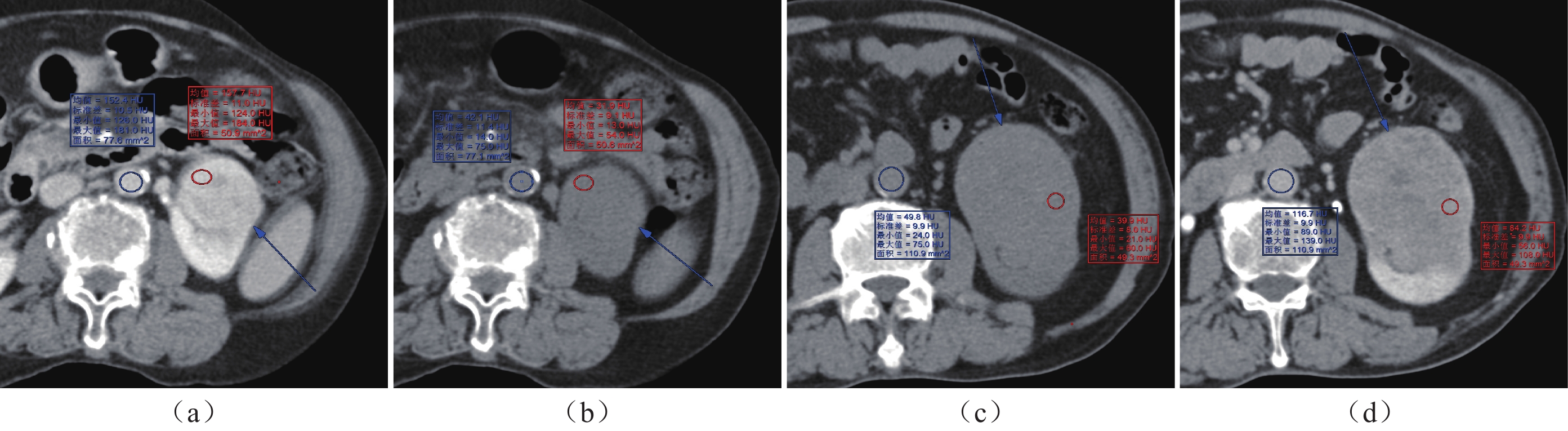
由一位副主任医师和一位高年资主治医师在不知病理分级的情况下分别进行数据测量,取其平均值为最终标准。选取轴位图像的肿瘤最大层面,在延迟期强化最明显区域及同层面腹主动脉内勾画圆形、椭圆形感兴趣区(Region Of Interest,ROI),然后复制ROI放置在平扫相同区域,ROI大小一致,测量两期CT值。肿瘤ROI 勾画时要避开肿瘤内部的囊变坏死、出血、钙化、强化血管等影响数值区域。腹主动脉ROI勾画时要避开增厚血管壁、钙化等区域。并计算延迟期主动脉净增值(∆HUAorta)、延迟期肿瘤净增值(∆HUtumor)和ECV。
∆HUAorta=主动脉延迟期CT值−主动脉平扫CT值;∆HUtumor =肿瘤延迟期CT值−肿瘤平扫CT值,[7-8]
ECV(%)=(1−HCT)×(∆HUtumor /∆HUAorta)×100% 。[7-8]
1.5 统计学分析
采用SPSS 27.0统计学软件,对高、低级别组ccRCC的变量特征进行对比分析。定性征象资料以频数(%)表示,行卡方检验。定量数值资料先行正态分布检验,符合者以
$\bar x\pm s$ 表示,行两独立样本t检验,不符合者以M(Q1,Q3)表示,行Mann-Whitney U检验。将P<0.05视为差异有统计学意义。将有统计学意义指标绘制受试者工作特征(receiver operating characteristic,ROC)曲线分析其在评价ccRCC病理分级中的诊断效能。2. 结果
2.1 两组ccRCC患者一般资料对比
本次研究的对象为67例ccRCC患者,男39例、女38例,年龄42~82岁,其中低级别组48例(含Ⅰ级13例,Ⅱ级35例),高级别组19例(Ⅲ级17例,Ⅳ级2例)。两组一般资料差异见表1,均无统计学意义(P>0.05)。
表 1 高、低级别ccRCC一般资料对比Table 1. Comparison of general data of high and low grade ccRCC病理分级 相关临床表现 性别 年龄(岁) HCT(%) 有 无 男 女 低级别(n=53) 12 36 18 30 58.50(51.00,71.75) 36.38±4.71 高级别(n=19) 8 11 11 8 63.00(55.00,71.00) 35.93±6.27 $\chi^2 $/t/Z值 1.902 2.306 −0.787 0.320 P值 0.168 0.129 0.432 0.750 注:将存在腰痛、血尿、腹部包块三联征中任1项归为有相关临床症状;将体检或因其他疾病检查发现肿瘤归为无症状。 2.2 两组ccRCC患者定量参数对比
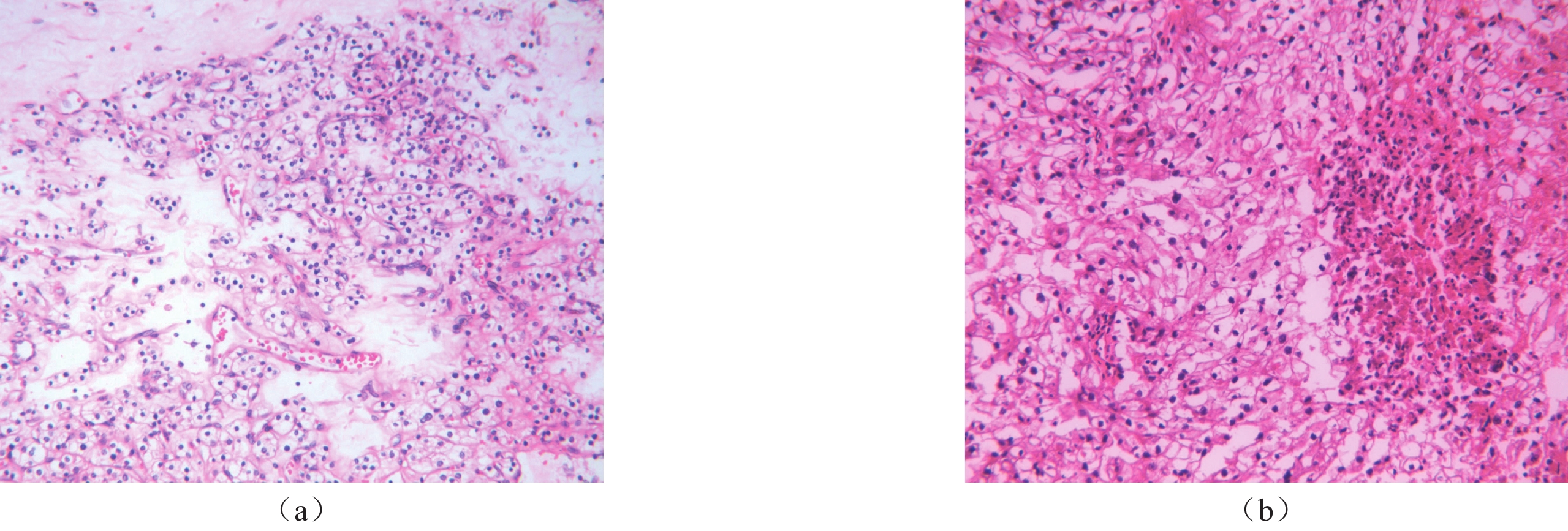
高、低级别组ccRCC的定量参数对比分析见表2。低级别组ccRCC的∆HUtumor、ECV均高于高级别组,有显著统计学差异(P<0.005)。高、低级别组ccRCC的∆HUAorta差异无统计学意义(P>0.005)。高、低级别ccRCC患者CT图像及定量参数测算示意图见图1。高、低级别ccRCC的病理图见图2。
表 2 高、低级别ccRCC定量参数对比Table 2. Comparison of quantitative parameters between high- and low-grade ccRCCs病理分级 ∆HUAorta(HU) ∆HUtumor(HU) ECV(%) 低级别(n=53) 73.35±18.18 64.90(54.18,79.25) 58.94(53.94,64.39) 高级别(n=19) 76.77±16.61 46.70(42.90,65.90) 41.68(40.87,46.92) t/Z值 −0.710 −2.852 −4.243 P值 0.480 0.004 <0.001 注:∆HUAorta:延迟期主动脉净增值;∆HUtumor:延迟期肿瘤净增值;ECV:细胞外容积分数。 2.3 定量参数的ROC曲线
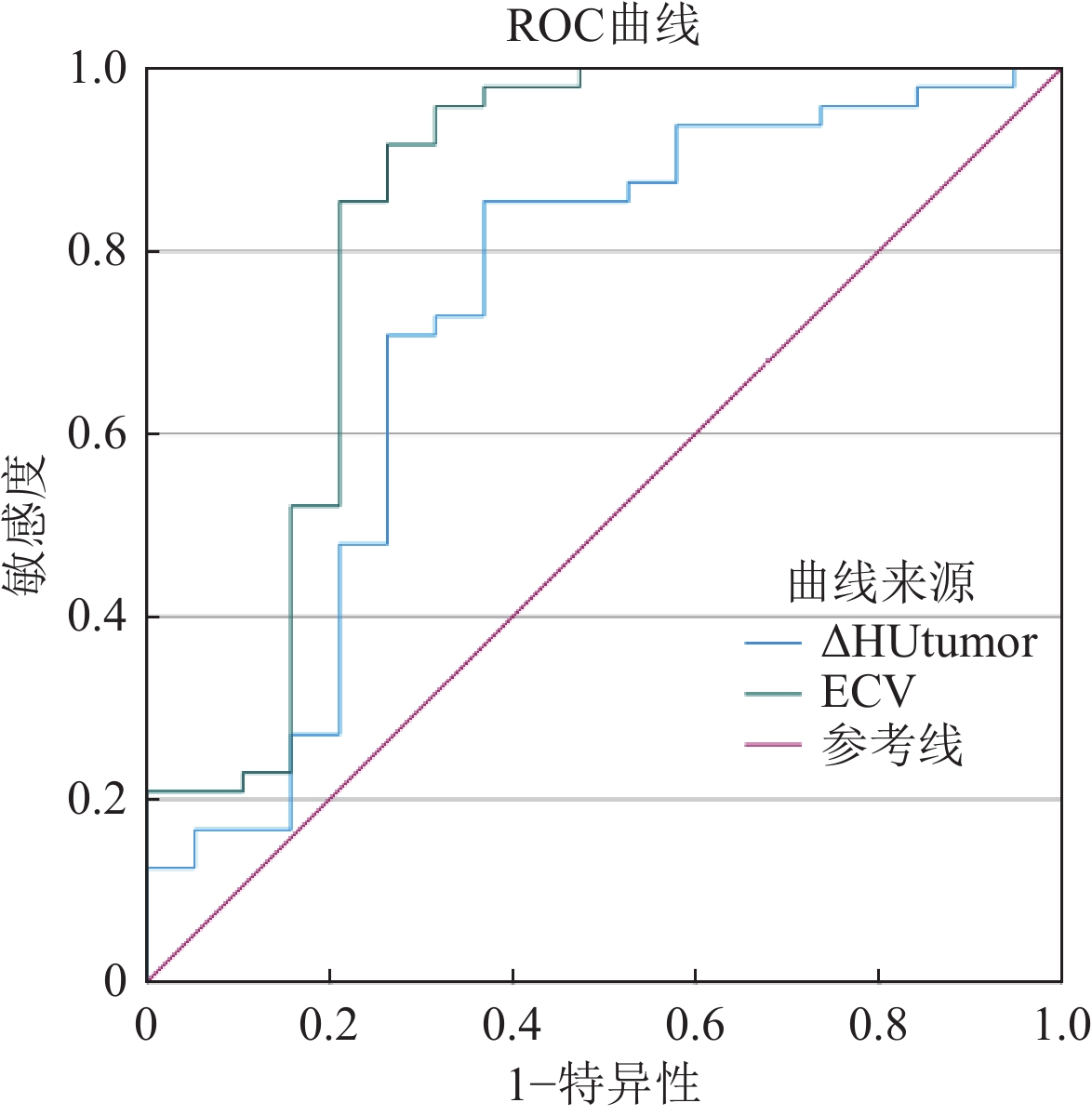
ROC曲线结果显示,ECV 的诊断效能(AUC: 0.834,95% CI:0.700~0.968,灵敏度:91.67%,特异度:73.68%,P=0.000),均高于∆HUtumor。上述参数见表3。两者的ROC曲线见图3。
表 3 ∆HUtumor及ECV诊断WHO/ISUP低级别ccRCC的效能分析Table 3. Efficacy of ∆HUtumor and ECV in diagnosing WHO/ISUP low-grade ccRCC指标 AUC(95%CI) 灵敏度/% 特异度/% 诊断阈值 P值 ∆HUtumor(HU) 0.725(0.575~0.875) 85.42 63.16 49.70 0.004 ECV(%) 0.834(0.700~0.968) 91.67 73.68 44.33 0.000 注:∆HUAorta:延迟期主动脉净增值;∆HUtumor:延迟期肿瘤净增值;ECV:细胞外容积分数。 3. 讨论
ccRCC的WHO/ISUP病理分级与肿瘤侵袭性、淋巴结及远处转移、预后密切相关[9],术前准确评估ccRCC的病理分级有着重大临床意义。以往研究中多通过在影像图像上分析ccRCC病灶的形态特征、强化特征 [10-12]来预测其病理分级,这些研究主观性较强,受限于研究者参差不齐的技能水平,导致结果差异较大,可重复性低,另也有研究影像组学特征[13]预测ccRCC病理分级,但流程较繁琐,不适用于日常工作。本研究试图利用基于CT的延迟期ECV评价ccRCC的病理分级,可能更具有客观性。
此次回顾性研究发现,低级别组ccRCC的∆HUtumor和ECV均高于高级别组,均有统计学差异,且ECV的P值更低(P<0.001),更具统计学差异,ROC曲线结果显示∆HUtumor 对ccRCC的病理学分级诊断价值中等(AUC:0.725),ECV诊断价值较高(AUC:0.834),具体分析如下:
ECV可作为量化细胞外基质(extra cellular matrix,ECM)的重要指标,且被证实与活检ECM结果的一致性较高[14]。ECM的改变在肿瘤的生长中作用重大,尤其微血管密度(MVD)、纤维化程度与肿瘤增殖、侵袭及病理分级密切相关[7-8,15]。MVD的增加及纤维化程度增加导致ECV的增高。增强扫描延迟期时,血管内外及细胞外的对比剂经过不断交换后分布达到相对稳定状态,此时测算出的ECV值更能客观反映肿瘤的ECM。
本研究中ccRCC的ECV与病理级别呈负相关,这种差异兴许和肿瘤恶性程度相关。低级别ccRCC肿瘤细胞排列稀疏,间质血管丰富、粗大(图2),形态规则,微血管密度(MVD)高,血管通透性高,造影剂易进入血管外细胞外间隙,高级别ccRCC恶性程度更高,生长迅速,细胞排列紧密,间质血管减少,易因血供不足致缺血缺氧发生坏死,时常肉眼难以识别,表现为组织学坏死(图2),MVD较低,MVD的差异与既往研究报道相符[16],直接引起低级别组ccRCC的ECV高于高级别组。周欣冉等[5]报道ECV与肝细胞癌病理分级呈负相关,提示低级别/高分化恶性肿瘤内存在更高的纤维化程度[17],本研究中的结果与其相符,笔者认为虽研究肿瘤类别不同,但同属于癌,可作类似解释,本研究中低级别ccRCC也更易出现纤维化(见图2),也证实了这一点。另低级别ccRCC的∆HUtumor高于高级别ccRCC,与张晓金等[18]报道相符,是因为高级别肿瘤易出现囊变坏死,包括组织学坏死,这些区域MVD较低,血供较少,还具有因肿瘤细胞压迫所致扭曲、形态不规则、粗细不均的成熟血管[19],通透性减低,血管外细胞外对比剂减少,导致增强扫描呈低强化。
ECV评价ccRCC的病理学分级的诊断效能高于∆HUtumor,是因为ECV是通过CT增强定量参数(∆HUtumor、∆HUAorta)和实验室检验指标(HCT)衍算所得,为多参数融合指标,相当于一个联合模型,能够减少假阳性和假阴性结果的出现,更具客观性。
当然,我们的研究也有局限性。首先,本研究为一项单一中心回顾性研究、样本量偏少、组间样本量有偏差。其次,手动绘制ROI时可能存在操作者主观性,会导致一定程度的偏倚。再者患者心功能状况差异可能也会造成些许偏倚。这些不足将在我们下一步研究中进行完善。
综上,基于CT的ECV可以作为一个无创、新兴的临床影像学量化指标用以评价ccRCC的WHO/ISUP病理分级,有助于为临床制定更精准的治疗方案提供依据。
-
表 1 高、低级别ccRCC一般资料对比
Table 1 Comparison of general data of high and low grade ccRCC
病理分级 相关临床表现 性别 年龄(岁) HCT(%) 有 无 男 女 低级别(n=53) 12 36 18 30 58.50(51.00,71.75) 36.38±4.71 高级别(n=19) 8 11 11 8 63.00(55.00,71.00) 35.93±6.27 $\chi^2 $/t/Z值 1.902 2.306 −0.787 0.320 P值 0.168 0.129 0.432 0.750 注:将存在腰痛、血尿、腹部包块三联征中任1项归为有相关临床症状;将体检或因其他疾病检查发现肿瘤归为无症状。 表 2 高、低级别ccRCC定量参数对比
Table 2 Comparison of quantitative parameters between high- and low-grade ccRCCs
病理分级 ∆HUAorta(HU) ∆HUtumor(HU) ECV(%) 低级别(n=53) 73.35±18.18 64.90(54.18,79.25) 58.94(53.94,64.39) 高级别(n=19) 76.77±16.61 46.70(42.90,65.90) 41.68(40.87,46.92) t/Z值 −0.710 −2.852 −4.243 P值 0.480 0.004 <0.001 注:∆HUAorta:延迟期主动脉净增值;∆HUtumor:延迟期肿瘤净增值;ECV:细胞外容积分数。 表 3 ∆HUtumor及ECV诊断WHO/ISUP低级别ccRCC的效能分析
Table 3 Efficacy of ∆HUtumor and ECV in diagnosing WHO/ISUP low-grade ccRCC
指标 AUC(95%CI) 灵敏度/% 特异度/% 诊断阈值 P值 ∆HUtumor(HU) 0.725(0.575~0.875) 85.42 63.16 49.70 0.004 ECV(%) 0.834(0.700~0.968) 91.67 73.68 44.33 0.000 注:∆HUAorta:延迟期主动脉净增值;∆HUtumor:延迟期肿瘤净增值;ECV:细胞外容积分数。 -
[1] 许竞泽, 杨天宇, 钮慧, 等. 透明细胞肾细胞癌中Sema4D的表达及临床意义[J]. 临床与实验病理学杂志, 2021, 37(12): 1435-1439. DOI: 10.13315/j.cnki.cjcep.2021.12.007. XU J Z, YANG T Y, NIU H, et al. Sema4D expression in clear cell renal cell carcinoma and its clinical significance[J]. Chinese Journal of Clinical and Experimental Pathology, 2021, 37(12): 1435-1439. DOI: 10.13315/j.cnki.cjcep.2021.12.007.
[2] 周露婷, 杨晓群, 王朝夫. 第五版WHO肾脏肿瘤新分类主要变化解读[J]. 临床与实验病理学杂志, 2022, 38(12): 1409-1413. DOI: 10.13315/j.cnki.cjcep.2022.12.001. [3] ZHEN Z, RUI W, HUI W, et al. Myocardial extracellular volume fraction quantification in an animal model of doxorubicin-induced myocardial fibrosis: a synthetic hematocrit method using 3T cardiac magnetic resonance.[J]. Quantitative Imaging in Medicine and Surgery, 2021, 11(2): 510-520. DOI: 10.21037/qims-20-501.
[4] 王荣锟. 基于CT的细胞外体积分数与肾透明细胞癌病理分级的相关性研究[D]. 吉林大学, 2021, DOI: 10.27162/d.cnki.gjlin.2021.006520. Correlation between CT-based extracellular volume fraction and pathological grading of renal clear cells[D]. Jilin University, 2021, DOI:10.27162/d.cnki.gjlin.2021.006520. (in Chinese).
[5] 周欣冉, 邹梦梦, 岳凤辉, 等. 基于增强CT的细胞外体积分数联合常规检验标志物在肝癌分级中的预测价值[J]. 分子影像学杂志, 2024, 47(4): 379-385. DOI: 10.12122/j.issn.1674-4500.2024.04.07. ZHOU X R, ZOU M M, YUE F H, et al. Predictive value of extracellular volume fraction combined with routine testing of markers in the classification of hepatocellular carcinoma based on enhanced CT[J]. Journal of Molecular Imaging, 2024, 47(4): 379-385. DOI: 10.12122/j.issn.1674-4500.2024.04.07.
[6] 孙琦, 孙丹琦, 卞雪莲, 等. 光谱CT细胞外体积分数术前诊断结直肠癌病理T分期及组织学分级的价值[J]. 临床放射学杂志, 2024, 43(05): 782-787. DOI: 10.13437/j.cnki.jcr.2024.05.023. SUN Q, SUN D Q, BIAN X L, et al. The Value of Spectral CT Extracellular Volume Fraction in Preoperative Diagnosis of Pathological T Stage and Histological Grade of Colorectal Cancer[J]. Journal of Clinical Radiology, 2024, 43(05): 782-787. DOI: 10.13437/j.cnki.jcr.2024.05.023.
[7] 李庆阳, 张宇琦, 包佳琪, 等. 基于CT细胞外体积分数用于腹部疾病进展[J]. 中国介入影像与治疗学, 2022, 19(12): 791-794. DOI: 10.13929/j.issn.1672-8475.2022.12.014. LI Q Y, ZHANG Y Q, BAO J Q, et al. Progress in CT-based extracellular volume fraction in abdominal diseases[J]. Chinese Journal of Interventional Imaging and Therapy, 2022, 19(12): 791-794. DOI: 10.13929/j.issn.1672-8475.2022.12.014.
[8] 王艺洁, 杨亚英, 魏博, 等. 基于MRI及CT的细胞外体积在恶性肿瘤中的应用与研究进展[J]. 磁共振成像, 2023, 14(09): 131-135. DOI: 10.12015/issn.1674-8034.2023.09.024. WANG Y J, YANG Y Y, WEI B, et al. : Application and research progress of extracellular volume based on MRI and CT in malignant tumor[J]. Chinese Journal of Magnetic Resonance Imaging, 2023, 14(09): 131-135. DOI:10.12015/issn. 1674-8034.2023.09.024. DOI: 10.12015/issn.1674-8034.2023.09.024. (in Chinese).
[9] DAGHER J, DELAHUNT B, RIOUX-LECLERCQ N, et al. Clear cell renal cell carcinoma: Validation ofWorld Health Organization/International Society of Urological Pathology Grading[J]. Histopatho Logy, 2017, 71(6): 918-925. DOI: 10.1111/his.13311.
[10] 刘厚军, 黄国权, 张虎, 等. CT增强联合外周血炎症指标诺模图术前诊断肾透明细胞癌WHO/ISUP分级[J]. 影像诊断与介入放射学, 2023, 32(4): 256-261. DOI: 10.3969/j.issn.1005-8001.2023.04.003. LIU H J, HUANG G Q, ZHANG H, et al. Preoperative diagnostic WHO/ISUP classification of clear cell renal cell carcinoma based on CT-enhanced combined with peripheral blood inflammatory indicator nomograms[J]. Diagnostic Imaging & Interventional Radiology, 2023, 32(4): 256-261. DOI: 10.3969/j.issn.1005-8001.2023.04.003. (in Chinese).
[11] 程蛰承, 李志坚, 徐骥, 等. 肾透明细胞癌64排多层螺旋CT直接征象与病理学分级的对比研究[J]. 肿瘤影像学, 2019, 28(02): 117-122. DOI: 10.19732/j.cnki.2096-6210.2019.02.010. CHENG Z C, LI XU J, et al. Comparison of the direct signs of clear cell RCC on 64-row spiral CT with pathological grading[J]. Oncoradiology, 2019, 28(02): 117-122. DOI: 10.19732/j.cnki.2096-6210.2019.02.010. (in Chinese).
[12] 石宇婷, 倪良平, 张岱, 等. 基于术前增强CT探讨肾透明细胞癌瘤周静脉特征与WHO/ISUP分级的关系[J]. 临床放射学杂志, 2023, 42(12): 1951-1955. DOI: 10.13437/j.cnki.jcr.2023.12.018. SHI Y T, NING N P, ZHANG D, et al. Relationship between peritumoral vein characteristics and WHO/ISUP grade of Renal Clear Cell Carcinoma based on preoperative enhanced CT[J]. Journal of Clinical Radiology, 2023, 42(12): 1951-1955. DOI: 10.13437/j.cnki.jcr.2023.12.018.
[13] 黄忠江, 姜增誉, 李健丁, 等. 基于增强CT影像组学联合临床特征预测高、低级别肾透明细胞癌[J]. 实用放射学杂志, 2022, 38(9): 1487-1490. DOI: 10.3969/j.issn.1002-1671.2022.09.022. HUANG Z J, JIANG Z Y, LI J D, et al. : Prediction of high- and low-grade clear cell renal cell carcinoma based on enhanced CT radiomics combined with clinical features[J]. Journal of Practical Radiology, 2022, 38(9): 1487-1490. DOI: 10.3969/j.issn.1002-1671.2022.09.022.
[14] NAKAMORI S, DOHI K, ISHIDA M, et al. Native T1 mapping and extracellular volume mapping for assessing diffuse myocardial fibrosis in dilated cardiomyopathy[J]. JACC Cardiovasc Imaging, 2018, 11(1): 48-59. DOI: 10.1016/j.jcmg.2017.04.006.
[15] OXBURGH L. Extracellular matrix environment of clear cell RCC [J/OL]. Cancers, 2022, 14(17): 4072[2023-03-19]. https://pubmed.ncbi.nlm.nih.gov/36077607/. DOI: 10.3390/cancers14174072.
[16] QI L, DU J, ZHANG Z, et al. Low differentiated microvascular density and low platelet-derived growth factor-BB (PDGF-BB) expression predict distant metastasis and poor prognosis in clear-cell renal cell carcinoma. BJU Int, 2013, 112(4): E415-E423.
[17] DESERT R, CHEN W, GE XD, et al. Hepatocellular carcinomasexhibiting intratumor fibrosis express cancer-specific extracellular matrix remodeling and WNT/TGFB signatures, which are associated with poor outcomes. Hepatology, 2023, 78(3): 741-57.
[18] 张晓金, 翟建, 张虎, 等. CT增强定量参数预测肾透明细胞癌WHO/ISUP分级[J]. CT理论与应用研究, 2023, 32(06): 746-752. DOI: 10.15953/j.ctta.2022.253. ZHANG X J, ZHAI J, ZHANG H, et al. Prediction of WHO/ISUP grading of renal clear-cell carcinoma using quantitative CT enhancement scanning[J]. CT Theory and Applications, 2023, 32(06): 746-752. DOI: 10.15953/j.ctta.2022.253.
[19] 王宁, 董景敏, 翟长彬, 等. CTA血管定量对肾透明细胞癌病理分级的可行性研究[J]. 滨州医学院学报, 2016, 39(05): 374-376.



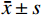
 下载:
下载: