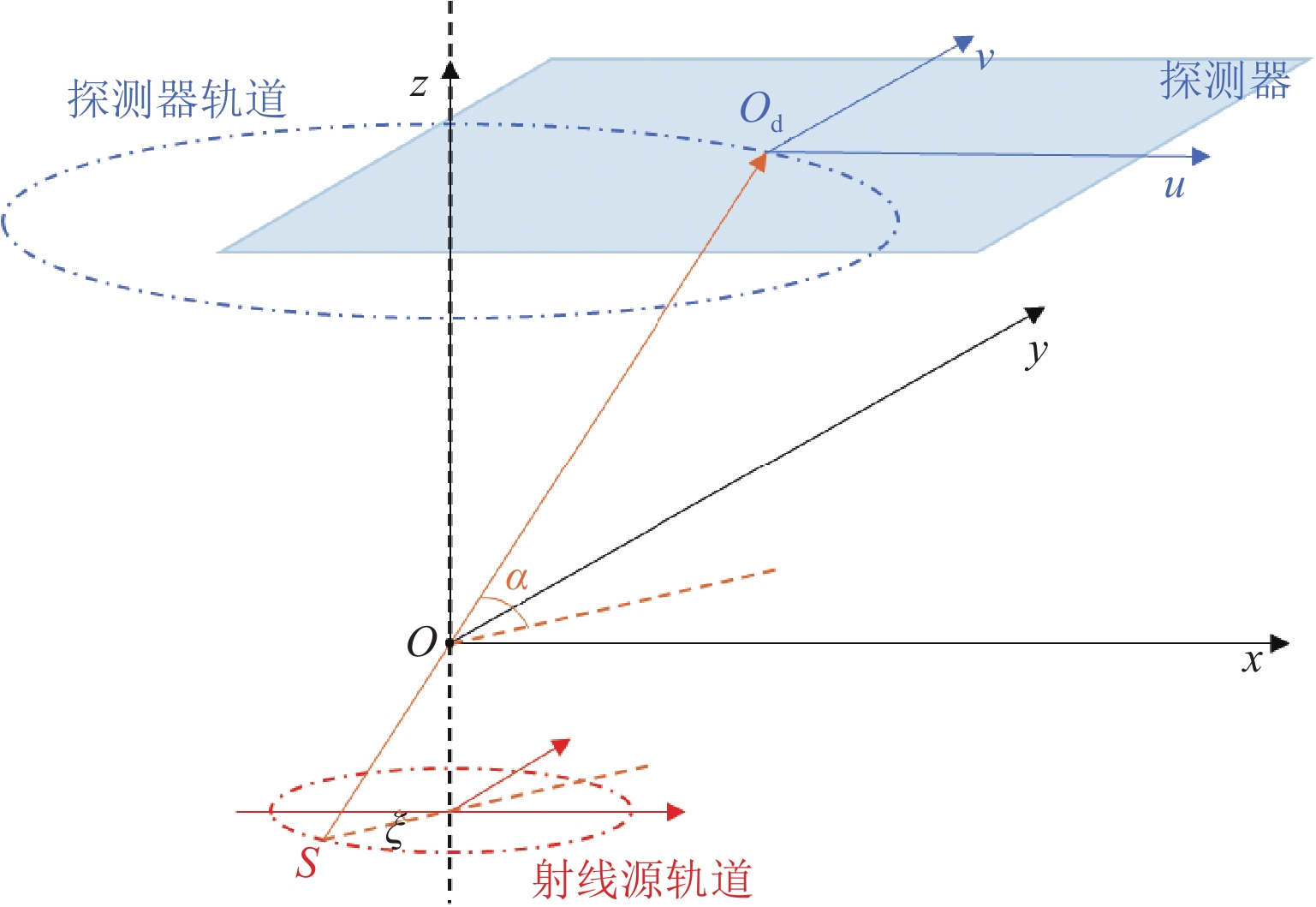
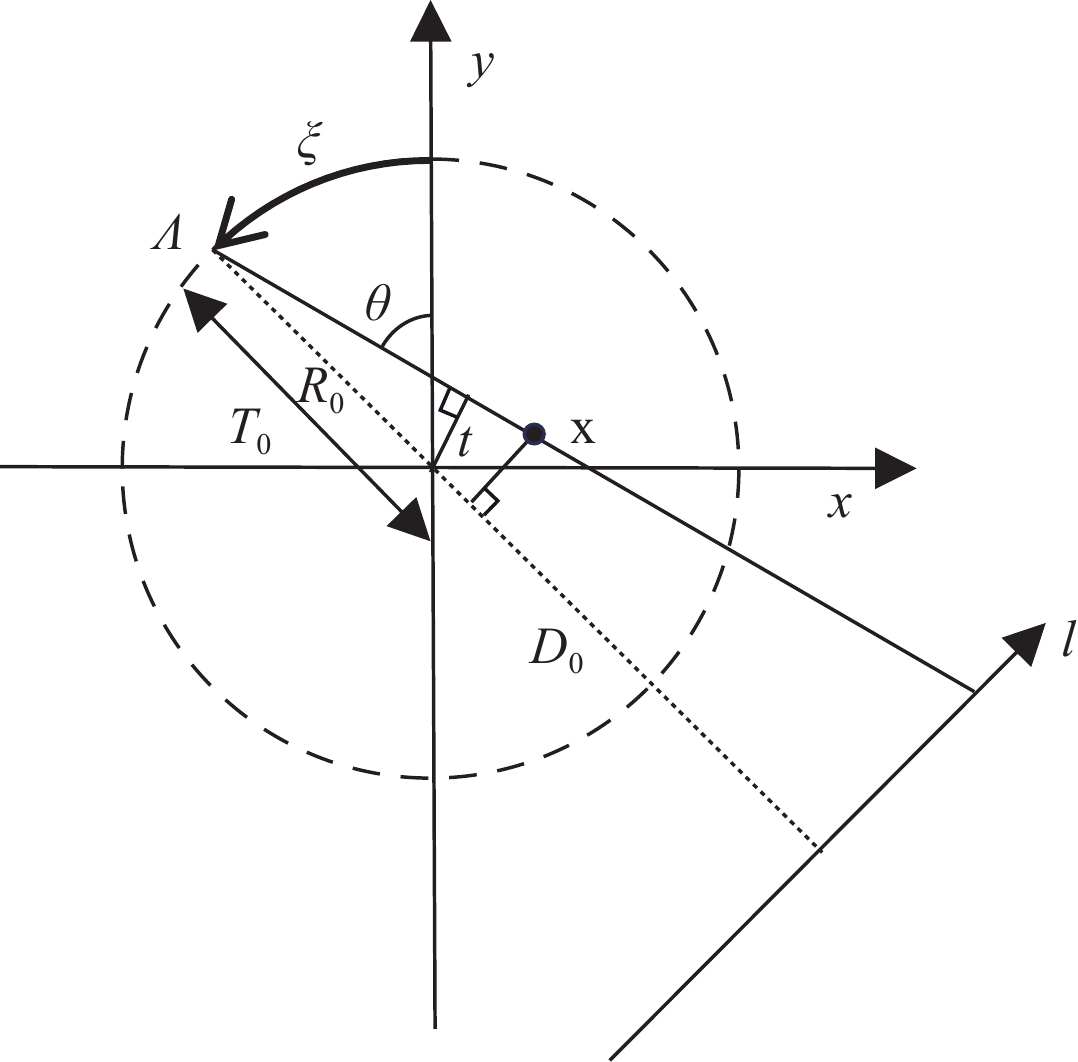
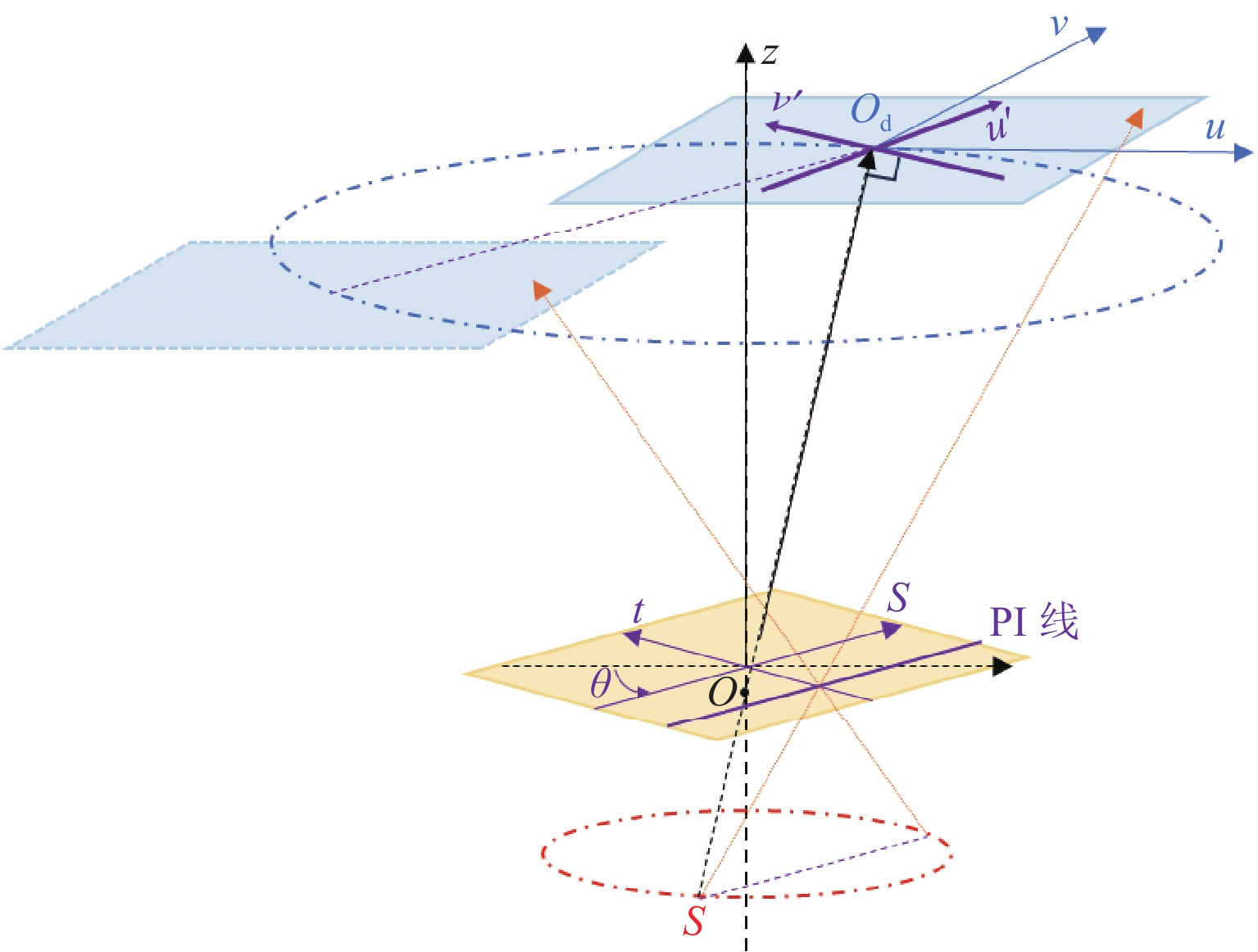
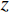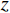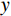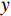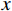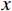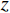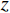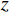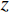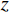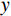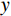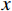Differentiated Backprojection Reconstruction Method for Square Cross-section FOV Rotational CL
-
摘要:
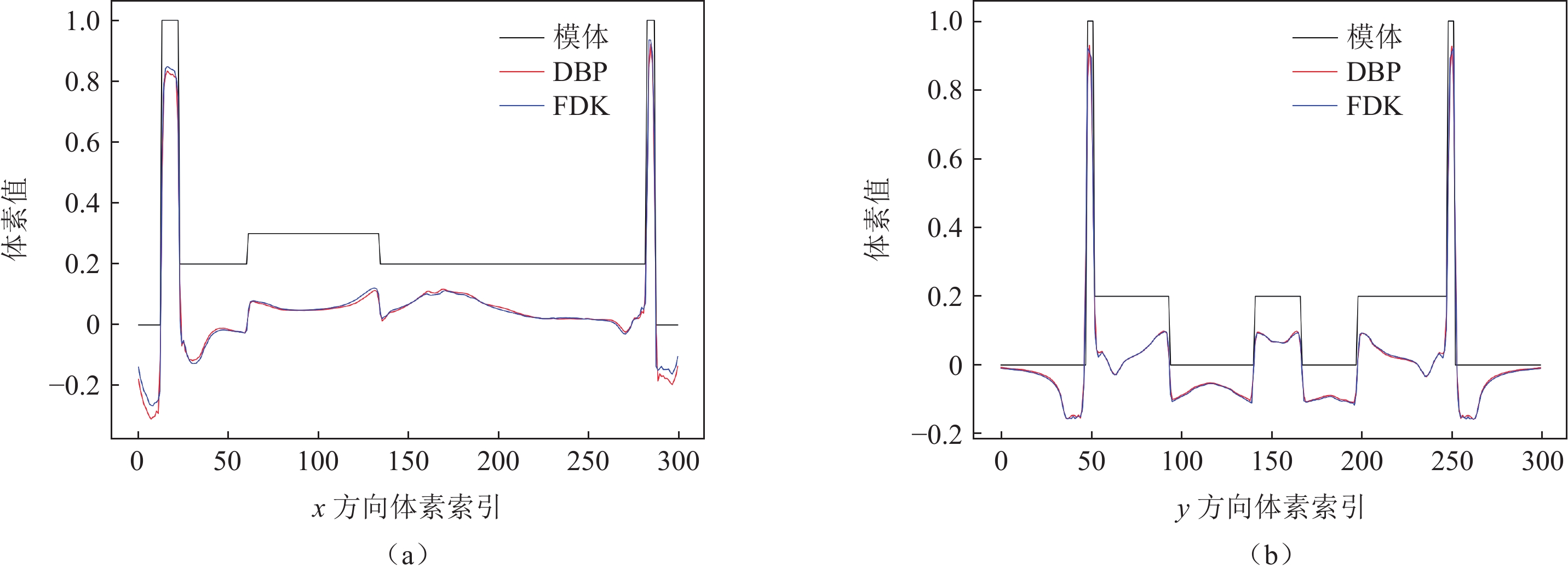
随着现代工业的发展,计算机断层成像(CT)在无损检测中发挥了重大的作用。由于成像视野或X射线穿透能力的限制,CT难以实现对板状物体的扫描和成像,针对板状物体的检测,通过更改扫描几何和重建算法,发展出了计算机层析成像技术(CL)。CL重建借鉴了CT重建方法,有解析重建方法和迭代重建方法,滤波反投影类算法快速但是重建与真值差距很大;迭代方法通常比解析重建准确,但是耗时很长。本文借鉴圆轨道扇束CT的微分反投影(DBP)重建方法,推导了方形截面视野旋转CL的DBP重建方法,以仿真数据和实际印刷电路板扫描数据进行重建,DBP方法的重建图像质量与滤波反投影算法相似,且在处理投影截断问题上有一定优势。
Abstract:With advancements in modern industry, computed tomography (CT) has played a significant role in nondestructive testing. However, owing to the limitations in the imaging field of view and X-ray penetration capability, CT faces challenges in the scanning and imaging of plate-like objects. To inspect plate-like objects, computer lithography (CL) has been developed by modifying the scanning geometry and reconstruction algorithms. CL reconstruction methods are inspired by CT reconstruction techniques and include analytical and iterative reconstruction methods. Filtered backprojection algorithms are fast, but often result in significant discrepancies from the true values, and iterative methods, although more accurate than analytical reconstruction, are usually time-consuming. This study draws on the differentiated backprojection (DBP) reconstruction method of circular trajectory fan-beam CT to derive a DBP reconstruction method for a square cross-sectional field-of-view (FOV) rotational CL. Using both simulated data and actual printed circuit board scanning data for reconstruction, the image quality of the DBP method was found to be similar to that of the filtered back projection algorithm, with certain advantages in addressing projection truncation challenges.
-
源于滤泡细胞的甲状腺癌占甲状腺恶性肿瘤的95%,其中的80%~85%是甲状腺乳头状癌(papillary thyroid carcinoma,PTC)[1]。手术是治疗PTC的首选方法,然而部分PTC患者术后易复发和远处转移,导致预后不良,甚至死亡[2]。相当研究表明,颈部中央区淋巴结转移(central lymph node metastasis,CLNM)是PTC患者预后差的独立危险因素[3]。由于目前临床缺少术前预测CLNM的有效技术,术中冰冻切片证实为PTC的病例,常规执行预防性的中央区淋巴结清扫(prophylactic lymph node dissection,PLND)[4]。然而,过度的PLND不仅增加患者不必要的损伤,甚至引起严重的并发症[5]。因此,探索建立术前精准评价PTC患者颈部淋巴结状态的有效新方法,成为亟待解决的重要科学问题。
目前,PTC患者颈部中央区淋巴结状态术前检查的方法主要包括体格检查、超声、CT、MRI和PET等,其中触诊的敏感性低于7%,超声和CT的敏感性为50%~60%[6-7],MRI和PET常因为呼吸道伪影的干扰,小的淋巴结不易显示[8]。甲状腺功能检查指标的水平与CLNM的发生的相关性也被广泛研究,但研究成果差异很大[9-11]。近年来,利用PTC原发灶的多参数特征构建模型术前预测CLNM逐渐成为研究热点,然而,大多数模型的建立涉及到术前不能明确或须经手术病理证实的特征,如甲状腺外侵犯、血管外侵犯、BRAFV600 E变异、桥本氏甲状腺炎(Hashimoto’s thyroiditis,HT)、TNM分期等[12],致使临床上应用受限。
本研究针对上述问题,以PTC患者术前临床信息、超声及CT影像学数据联合甲状腺功能检查的多参数特征为基础,构建预测模型,精准预测PTC患者的颈部CLNM。其特点是所有的预测因素术前可得,同时考虑到原发病灶与CLNM确定的对映关系,我们选择单灶性PTC,以增加研究结果的可解释性。
1. 对象和方法
1.1 病例筛选
连续收集2019年1月至2023年12月在我院外科行甲状腺癌根治术患者的临床、CT、超声及实验室检查的资料。上海市金山区亭林医院伦理委员会批准此项研究,所有的患者免除签订知情同意书。
纳入标准:患者甲状腺腺叶或全甲状腺切除术+颈部中央区淋巴结清扫,术后病理是单灶性PTC;术前两周在我院行甲状腺CT增强检查;术前两周在我院行甲状腺超声检查;术前一周在我院行甲状腺功能检查。
排除标准:PTC最大径小于3 mm;既往有甲状腺或头颈部其他肿瘤手术史;Graves病;图像质量欠佳;临床信息不完整。
按照纳入标准和排除标准,340例患者入组本研究。
1.2 方法
本研究方法包括变量的定义和分类;根据变量的性质选择不同的统计方法;以及选择用于模型构建的编程语言等。
2. 图像分析
2.1 临床特征和甲状腺功能检查指标
性别(男和女);年龄分组(≤55岁和>55岁);TSH(参考值,以下同:0.55~4.78 mIU/L);fT3(3~6.3 pmol/L);fT4(10.3~24.5 pmol/L);TT3(1.3~3.1 nmol/L);TT4(66~181 nmol/L);TG-Ab(0~60 IU/ml);TPO-Ab(0~60 IU/ml)。
2.2 CT影像特征
在未知CLNM病理结果的情况下,由两位具有10年以上头颈部放射诊断工作经验的医师(医师1和医师2)各自分析340例患者的CT图像特征。包括,CT值:正常甲状腺实质和同侧胸锁乳突肌的平扫CT值和差值,两者感兴趣区保持面积一致;PTC与甲状腺被膜接触程度:依据PTC与甲状腺包膜最大接触长度与肿瘤周长的比值,分为0、<25%、25%~50%和>50%;病灶位置分布:位置1(左叶、峡部、右叶)、位置2(上部、中部、下部);病灶实质构成:依据病灶内是否存在液性无强化区分为实性、囊实性及囊性。两位医师意见不一致时通过讨论或者咨询医师3(具有16年头颈部放射诊断工作能力)决定。
2.3 超声影像特征
在未知CLNM病理结果的情况下,两位具有8年以上甲状腺超声诊断工作经验的医师(医师4和医师5)分析340例患者的甲状腺超声图像特征。包括:病灶回声特点(低回声、等回声、高回声);形态特征(圆形或类圆形,边缘无明显分叶状或刺状定义为规则);肿瘤边界(肿瘤边缘与正常甲状腺实质界限可辨,称为清晰);肿瘤最大径(≤10 mm和>10 mm);肿瘤前后径(A)和左右径(T),并计算A/T比(≤1和>1);钙化特点(无钙化、直径≤3 mm和>3 mm);彩色多普勒血流显像(CDFI) (无血流、周围血流、中央血流、周围+中央血流)。
3. 统计学分析
单因素分析中,符合正态分布的计量资料用(
$\bar x \pm s $ )表示,t检验分析,不符合正态分布的计量资料用Mann-Whitney U检验;计数资料用Pearson$ \chi^ 2 $ 检验(最小期望值≤5用Fisher精确$ \chi ^2 $ 检验);多因素logistic回归向前法筛选IRF;列线图的评价指标包括ROC曲线、calibration和DCA;医师之间的评判一致性用Kappa检验。所有的假设检验采用双尾检验,P<0.05表示差别有统计学意义,使用的软件包括SPSS19(SPSS/IBM,Chicago)和R2.15.3软件。4. 结果
本研究的340例PTC患者中,男性88例(25.9%),女性252例(74.1%),年龄范围19~83岁(50.60±13.243)。131例患者发生了CLNM(38.5%,男性50例,女性81例)。2个临床特征(年龄分组、性别)、4个CT影像特征(位置、内部构成、被膜接触、差值)、7个超声影像特征(回声、边缘、边界、最大径、A/T比、钙化、CDFI)以及甲状腺功能检查的7项指标被纳入研究。医师1、2和4、5之间各个征象评价一致性的Kappa检验系数>0.75。年龄≤55岁、男性性别以及肿瘤最大径>10 mm是CLNM的高危因素,PTC与被膜接触、边缘不规则生长、钙化以及病灶内发生囊变更容易发生CLNM,差异有统计学意义(表1和表2)。
表 1 CLNM分组的临床和实验室特征单因素分析Table 1. Univariate analysis of clinical and laboratory characteristics in the CLNM group特征 CLNM(n=131) Non-CLNM(n=209) T值 P值 年龄 46.27±13.68 53.32±12.23 -4.933 0.000 年龄分组(n%) 11.284 0.001 ≤55 93(71.0) 110(52.6) >55 38(29.0) 99(47.4) 性别(n%) 16.768 0.000 男 50(38.2) 38(18.2) 女 81(61.8) 171(81.8) TSH 1.933±1.117 2.086±1.173 -1.13 0.259 fT3 5.101±0.781 4.975±0.663 1.584 0.114 fT4 17.414±3.682 17.382±2.955 0.086 0.932 T3 1.768±0.322 1.755±0.316 0.345 0.730 T4 111.3±25.346 113.0±24.016 1.233 0.218 TG-Ab 22701 35269 -0.423 0.673 TPO-Ab 22332.5 35673.5 -0.004 0.997 表 2 CLNM分组的影像特征单因素分析Table 2. Univariate analysis of imaging characteristics in the CLNM group特征 CLNM(n=131) Non-CLNM(n=209) T值 P值 边缘(n%) 17.044 0.000 规则 23(17.6) 81(38.8) 不规则 108(82.4) 128(61.2) 边界(n%) 0.123 0.725 清晰 92(70.2) 143(68.4) 模糊 39(29.8) 66(31.6) 位置1(n%) 1.861 0.394 右叶 59(45.0) 103(49.3) 峡部 14(10.7) 14(6.7) 左叶 39(29.8) 92(44.0) 位置2(n%) 0.395 0.821 上 32(24.4) 45(21.5) 中 64(48.9) 107(51.2) 下 35(26.7) 57(27.3) 实质构成(n%) 7.83 0.005 实性 93(71.0) 175(83.7) 囊实性 38(29.0) 34(16.3) 被膜接触(n%) 34.526 0.000 0 8(6.1) 51(24.4) <25% 34(26.0) 62(29.7) 25%~50% 35(26.7) 61(29.2) >50% 54(41.2) 35(16.7) 最大径(n%) 32.544 0.000 ≤10 mm 66(50.4) 167(79.9) >10 mm 65(49.6) 42(20.1) A/T 比(n%) 0.003 0.959 ≤1 83(63.4) 133(63.6) >1 48(36.6) 76(36.4) 钙化(n%) 9.201 0.010 无 44(33.6) 105(50.2) ≤3 mm 72(55.0) 84(40.2) >3 mm 15(11.5) 20(9.6) CDFI(n%) 5.073 0.167 无 60(45.8) 118(56.5) 周围 24(18.3) 38(18.2) 中央 40(30.5) 47(22.5) 周围+中央 7(5.3) 6(2.9) 差值* 33.09±16.459 34.37±16.754 -0.693 0.489 注:*甲状腺实质与同侧胸锁乳突肌CT值之差。 对单因素分析中P值<0.05的特征(年龄分组、性别、肿瘤最大径、被膜接触、实质构成、边缘以及肿瘤内钙化)进行多因素logistics回归向前法分析,结果表明,年龄≤55岁、男性性别、肿瘤最大径>10 mm、被膜接触>0以及边缘不规则是CLNM的IRFs(表3)。
表 3 340例PTC患者CLNM的多因素logistics回归分析Table 3. Multivariate logistic regression analysis for CLNM in 340 patients with PTC变量 估计值 标准误 Z值 P 值 截距 -2.596 0.688 -3.773 0.000 年龄(>55) -0.755 0.332 -2.272 0.023 性别(女) -0.993 0.362 -2.739 0.006 边缘(不规则) 1.153 0.390 2.856 0.003 最大径(>10 mm) 1.051 0.362 2.898 0.003 构成(囊实性) 0.343 0.397 0.863 0.388 被膜接触 <25% 1.791 0.622 2.879 0.004 25%~50% 2.005 0.623 3.217 0.001 >50% 2.520 0.632 3.984 0.000 钙化 ≤3 mm 0.003 0.350 0.008 0.993 >3 mm 0.515 0.591 0.871 0.384 340名PTC患者以7∶3随机分成训练组(n=273)和验证组(n=103),IRFs在随机分组中的差异无统计学意义(表4)。依据IRFs在多因素logistic回归分析中的权重,在训练组构建列线图(nomogram)(图1),并在验证组验证。结果显示,Nomogram的ROC在训练组的曲线下面积(area under the curve,AUC)为0.815(95%CI:0.761~0.870),在验证组中的AUC值0.747(95%CI:0.646~0.848)(图2)。Nomogram预测个体患者CLNM发生概率的实例演示如图3。
表 4 340例PTC患者7:3比例随机分组中IRF的比较Table 4. Comparison of IRFs in the training and validation cohorts where 340 PTC patients were randomly divided into at a 7:3 ratio特征 训练组(n=237) 验证组(n=103) T值 P值 年龄分组(n%) 0.015 0.904 ≤55 141(59.5) 62(60.2) >55 96(40.5) 41(39.8) 性别(n%) 0.200 0.655 男 63(26.6) 25(24.3) 女 174(73.4) 78(75.7) 边缘(n%) 1.325 0.250 规则 68(28.7) 36(35,0) 不规则 169(71.3) 67(65.0) 被膜接触(n%) 1.903 0.593 0 45(19.0) 14(13.6) <25% 68(28.7) 28(27.2) 25%~50% 64(27.0) 32(31.1) >50% 60(25.3) 29(28.2) 最大径(n%) 0.162 0.687 ≤10 mm 164(69.2) 69(67.0) >10 mm 73(30.8) 34(33.0) ![]() 图 3 Nomogram预测CLNM的性能演示(界值为0.303)注:患者1,男性,44岁,PTC病例,CLNM阳性。CT平扫示右叶中下部类圆形病灶,内见钙化,与甲状腺被膜接触约75%(a),增强后不均匀强化(b),超声显示低回声区,境界清晰,边缘光整,约20.6×16,5×18,5 mm(c),对照Nomogram:男性(38分)+年龄<55岁(28分)+被膜接触>50%(100分)+最大径>10 mm(45分)=211分,对应的CLNM预测概率0.73。患者2,女性,37岁,PTC病例,CLNM阴性。右叶内不规则低密度结节,边缘与被膜无接触(d),增强后轻度强化(e),超声显示境界清晰,边缘不光整的低回声区,最大径约8.5 mm(f),对照Nomogram:年龄<55岁(28分)+边缘不规则(48分)=76分,对应的CLNM预测概率0.10。Figure 3. Performance of the nomogram for CLNM (cutoff=0.303)
图 3 Nomogram预测CLNM的性能演示(界值为0.303)注:患者1,男性,44岁,PTC病例,CLNM阳性。CT平扫示右叶中下部类圆形病灶,内见钙化,与甲状腺被膜接触约75%(a),增强后不均匀强化(b),超声显示低回声区,境界清晰,边缘光整,约20.6×16,5×18,5 mm(c),对照Nomogram:男性(38分)+年龄<55岁(28分)+被膜接触>50%(100分)+最大径>10 mm(45分)=211分,对应的CLNM预测概率0.73。患者2,女性,37岁,PTC病例,CLNM阴性。右叶内不规则低密度结节,边缘与被膜无接触(d),增强后轻度强化(e),超声显示境界清晰,边缘不光整的低回声区,最大径约8.5 mm(f),对照Nomogram:年龄<55岁(28分)+边缘不规则(48分)=76分,对应的CLNM预测概率0.10。Figure 3. Performance of the nomogram for CLNM (cutoff=0.303)Nomogram的预测准确性和临床实用性用Calibration和DCA评价(图4和图5),calibration显示预测概率和实际概率在训练训练组和验证组中一致性程度很高。DCA曲线表明,当个体患者预测概率在0.1到0.85范围内,Nomograms预测CLNM的净收益高于无预测组或全部干预组。
5. 讨论
术前精准评价PTC患者颈部淋巴结状态,对于制定临床手术方案、提升患者生存质量具有重要的意义。然而,目前临床对于甲状腺乳头状癌CLNM的术前精准预测方面一直面临巨大挑战。
相当研究表明,年龄≤55岁、男性性别以及肿瘤最大径>10 mm是PTC患者发生CLNM的IRFs[13-14],这与本研究的结果发现相一致。分析认为,不健康的生活习性如抽烟、酗酒以及更高的基础代谢潜在地加速了肿瘤的扩散,可能是低龄男性PTC患者更易于发生CLNM的原因[13,15]。Huang等[16]研究发现常规PTC中,肿瘤直径越大越容易发生多个CLNM。
被膜侵犯是预测甲状腺癌颈部淋巴结转移的重要因素[17],分析认为其机制可能与肿瘤组织突破甲状腺被膜,并侵犯被膜内的淋巴系统有关。本研究中,定义的被膜接触是指CT影像上瘤体与甲状腺被膜之间无甲状腺组织的直接接触,区别于病理上的被膜侵犯。本研究中的被膜接触可以理解为被膜侵犯一种影像征象。被膜接触在术前的CT图像上易于识别和准确定量,正常甲状腺实质高密度的背景下,PTC均表现为低密度,CT平扫期能够清晰地观察到被膜接触的长度。患有HT的患者,甲状腺实质的背景密度减低,可以结合增强动脉期或静脉期的影像比较观察。
HT患者伴发PTC的几率增高,且高于其他类型的甲状腺癌[9]。我们比较了正常甲状腺实质与胸锁乳突肌的CT值差值(考虑到不同机型、不同扫描参数可能引起相同层面CT值的不同,但同一层面不同组织的CT差值可能不变)。研究结果显示差值越小,HT的发生率越高(22.33±15.54 vs 38,22±14.697,P<0.001),但与CLNM的发生无相关性。
研究表明,PTC瘤体发生囊变的机制主要是由癌细胞产生的胶质被液化而形成,因此PTC囊变通常表明肿瘤具有更高的恶性度[18],产生更高的侵袭性和转移能力,因此,也更容易发生CLNM。甲状腺结节内微钙化的检出对甲状腺癌的诊断有高度特异性,特别是PTC[19]。本研究中,单因素分析显示瘤体内囊变和钙化与CLNM的发生都存在相关性,但多因素分析显示缺乏相关性,因此,它们与CLNM的相关性需要进一步研究。
文献中有较多关于甲状腺功能检测指标预测CLNM的报道。Yu等[10]研究认为TPO-Ab和TG-Ab对预测CLNM都有价值,但作用互为相反;岳潇潇等[11]发现甲状腺功能检测指标的水平与PTC是否有淋巴结转移不相关。本研究对340例患者的血清TSH、FT3、FT4、T3、T4、TG-Ab、TPO-Ab表达水平行单因素分析(后两者为偏态分布资料,我们做了Wilcoxon秩和检验),但结果未能显示与CLNM之间的相关性,相关的数据还需要进一步研究证实。
本研究的贡献之处在于,一旦术中冰冻切片确诊为PTC后,外科医生易于根据术前多参数资料计算CLNM的发生概率,辅助决定是否需要预防性的淋巴结清扫,尽可能避免扩大手术范围和不必要的损伤。
本研究的局限性在于,首先,回顾性研究可能会引入一些选择偏倚;其次,单中心、小样本量以及外部验证的缺少,模型可能存在拟合优度过度的问题,产生的Nomogram泛化能力相对较弱;再次,本研究目的是精准分析术前单个PTC的预测能力,排除了多灶瘤及最大径小于3 mm的病例,须经术后病理确诊的特征也未被纳入,模型的预测效能不可避免地降低。尽管存在上述不利因素,我们的模型仍然展示了很好的预测能力和临床实用性,更优质的模型需要多中心、大样本量以及强大的外部验证进一步研究。
-
表 1 仿真参数
Table 1 Simulation parameters
模体像素/mm3 模体体素数量
($ z $×$ y $×$ x $)探测器像素/mm2 探测器数量
($ u $×$ v $)旋转角范围/° 旋转角采
样数量源探距
$ S{O}_{\mathrm{d}} $/mm源轴距
$ SO $/mm倾斜角
$ \alpha $/°0.0065 360×600×600 0.1376 2350×350 0−360 512 269.378 25.058 45 表 2 重建算法RMSE与MSSIM比较
Table 2 Comparison of root mean square error (RMSE) and mean structural similarity (MSSIM) for reconstruction algorithms
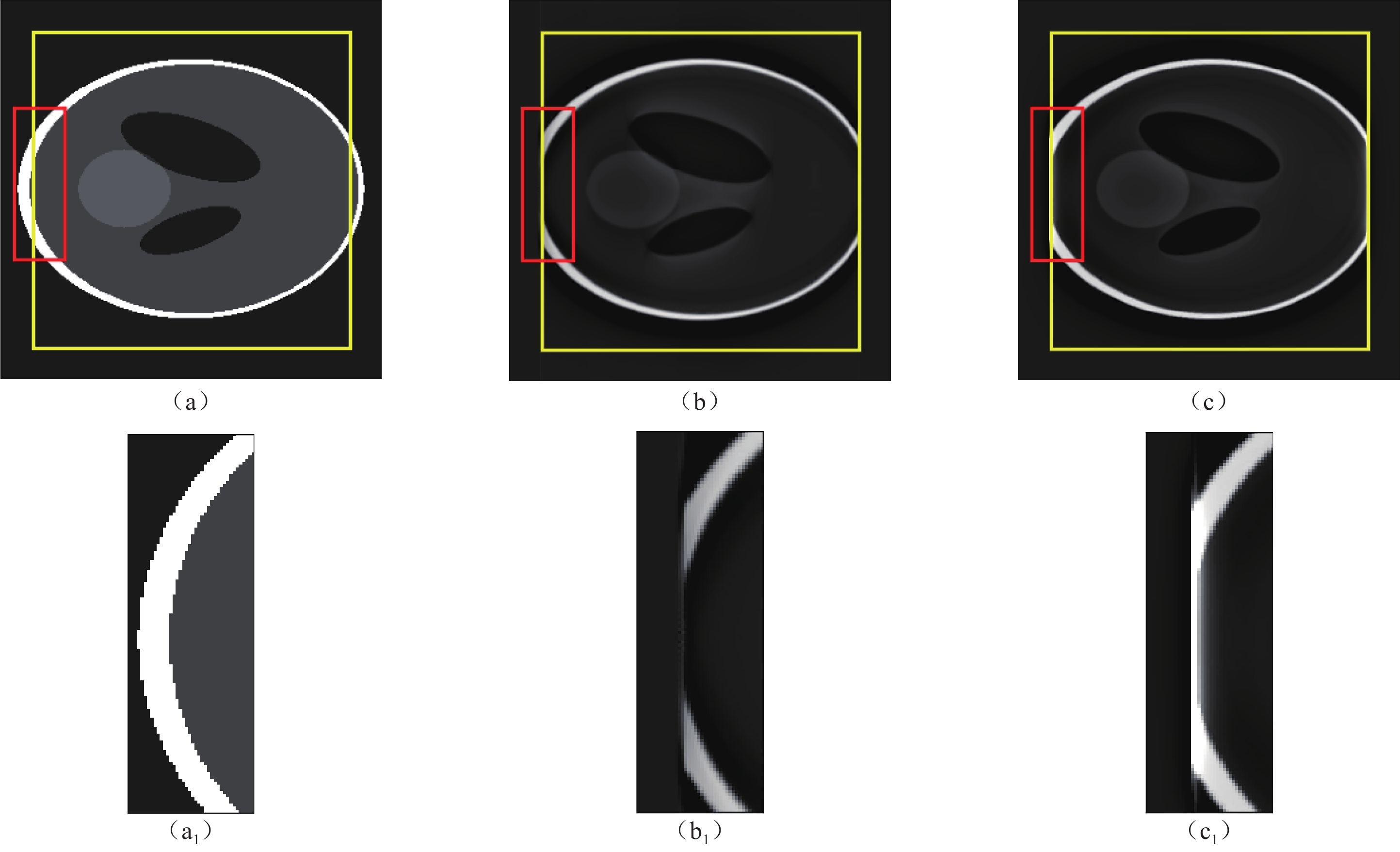
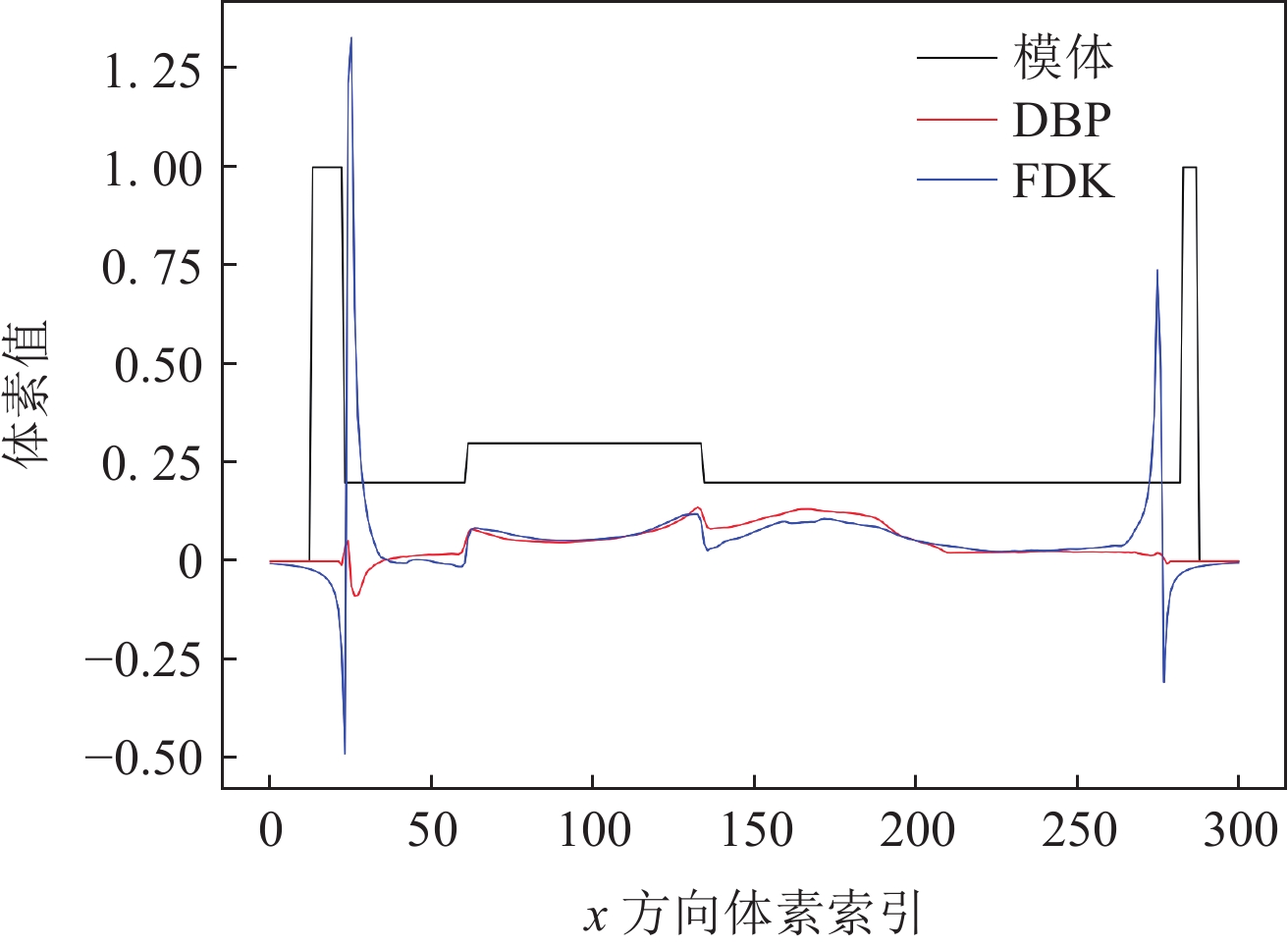
重建算法 DBP FDK RMSE 0.1517 0.1486 MSSIM 0.4108 0.4184 表 3 黄色框内区域RMSE与MSSIM比较
Table 3 Comparison of root mean square error (RMSE) and mean structural similarity (MSSIM) in the yellow box area
重建算法 DBP FDK RMSE 0.1664 0.1662 MSSIM 0.5265 0.4581 表 4 扫描参数
Table 4 Scan parameters
探测器像素/mm2 探测器数量($ u $×$ v $) 旋转角范围/° 旋转角采样数量 源探距$ S{O}_{\mathrm{d}} $/mm 源轴距$ SO $/mm 倾斜角$ \alpha $/° 0.1376 2750×750 0−360 256 256.904 23.898 45 表 5 实际投影重建时间
Table 5 Actual projection reconstruction time
旋转角采样数量 探测器数量($ u $×$ v $) 重建体素数量($ z $×$ y $×$ x $) DBP重建时间/s FDK重建时间/s 256 750×750 100× 1000 ×1000 30.84 9.87 -
[1] 曹大泉, 王雅霄, 阙介民, 等. 基于SART算法的CL硬化伪影校正方法研究[J/OL]. 原子能科学技术, 2014, 48(7): 1314-1320. DOI: 10.7538/yzk.2014.48.07.1314. CAO D Q, WANG Y X, QUE J M, et al. Research of beam hardening correction method for CL system based on SART algorithm[J/OL]. Atomic Energy Science and Technology, 2014, 48(7): 1314-1320. DOI:10.7538/yzk.2014.48.07.1314. (in Chinese).
[2] YANG M, WANG G, LIU Y. New reconstruction method for x-ray testing of multilayer printed circuit board[J/OL]. Optical Engineering, 2010, 49(5): 056501-056501. DOI: 10. 1117/1. 3430629.
[3] MYAGOTIN A, VOROPAEV A, HELFEN L, et al. Efficient volume reconstruction for parallel-beam computed laminography by filtered backprojection on Multi-Core clusters[J/OL]. IEEE transactions on image processing, 2013, 22(12): 5348-5361. DOI: 10.1109/TIP.2013.2285600.
[4] VOROPAEV A, MYAGOTIN A, HELFEN L, et al. Direct Fourier inversion reconstruction algorithm for computed laminography[J]. IEEE Transactions on Image Processing, 2016, 25(5): 2368-2378. DOI: 10.1109/TIP.2016.2546547.
[5] SUN L, ZHOU G, QIN Z, et al. A reconstruction method for cone-beam computed laminography based on projection transformation[J]. Measurement Science and Technology, 2021, 32(4): 045403.
[6] GORDON R, BENDER R, HERMAN G T. Algebraic reconstruction techniques (ART) for three-dimensional electron microscopy and x-ray photography[J]. Journal of Theoretical Biology, 1970, 29(3): 471, IN1, 477-476, IN2, 481. DOI: 10.1016/0022-5193(70)90109-8.
[7] GILBERT P. Iterative methods for the three-dimensional reconstruction of an object from projections[J]. Journal of Theoretical Biology, 1972, 36(1): 105-117. DOI: 10.1016/0022-5193(72)90180-4.
[8] ANDERSEN A H, KAK A C. Simultaneous algebraic reconstruction technique (SART): A superior implementation of the ART algorithm[J]. Ultrasonic Imaging, 1984, 6(1): 81-94. DOI: 10.1016/0161-7346(84)90008-7.
[9] HEBERT T, LEAHY R. A generalized EM algorithm for 3-D bayesian reconstruction from poisson data using gibbs priors[J/OL]. IEEE Transactions on Medical Imaging, 1989, 8(2): 194-202. DOI: 10.1109/42.24868.
[10] DOBBINSobbins J T, GODFREY D J. Digital X-ray tomosynthesis: Current state of the art and clinical potential[J/OL]. Physics in Medicine & Biology, 2003, 48(19): R65-R106. DOI: 10.1088/0031-9155/48/19/R01.
[11] LAURITSCH G, HAERER W H. Theoretical framework for filtered back projection in tomosynthesis[C]. Proceedings of SPIE: 1998: 1127-1137. DOI: 10.1117/12.310839.
[12] LEVAKHINA Y M, MVLLER J, DUSCHKA R L, et al. Weighted simultaneous algebraic reconstruction technique for tomosynthesis imaging of objects with high-attenuation features[J/OL]. Medical Physics (Lancaster), 2013, 40(3): 031106-n/a. DOI: 10.1118/1.4789592.
[13] ZhAO Y, XU J, LI H, et al. Edge information diffusion-based reconstruction for cone beam computed laminography[J]. IEEE transactions on image processing, 2018, 27(9): 4663-4675. DOI: 10.1109/TIP.2018.2845098.
[14] NOO F, CLACKDOYLE R, PACK J D. A two-step Hilbert transform method for 2D image reconstruction[J/OL]. Physics in Medicine & Biology, 2004, 49(17): 3903-3923. DOI: 10.1088/0031-9155/49/17/006.
[15] ZOU Y, PAN X. Exact image reconstruction on PI-lines from minimum data in helical cone-beam CT[J/OL]. Physics in medicine & biology, 2004, 49(6): 941-959. DOI: 10.1088/0031-9155/49/6/006.
[16] PACK J D, NOO F, CLACKDOYLE R. Cone-beam reconstruction using the backprojection of locally filtered projections[J/OL]. IEEE Transactions on Medical Imaging, 2005, 24(1): 70-85. DOI: 10.1109/TMI.2004.837794.
[17] KUDO H, SUZUKI T, Rashed E A. Image reconstruction for sparse-view CT and interior CT—introduction to compressed sensing and differentiated backprojection[J]. Quantitative Imaging in Medicine and Surgery, 2013, 3(3): 147.
[18] TANG S, TANG X. Radial differential interior tomography and its image reconstruction with differentiated backprojection and projection onto convex sets[J]. Medical Physics, 2013, 40(9): 091914.
[19] HAN Y, YE J C. One network to solve all ROIs: Deep learning CT for any ROI using differentiated backprojection[J]. Medical Physics, 2019, 46(12): e855-e872.
[20] ERNST P, ROSE G, NVRNBERGERA. Sparse view deep differentiated backprojection for circular trajectories in cbct[C]//Proceedings of the 16th Virtual International Meeting on Fully 3D Image Reconstruction in Radiology and Nuclear Medicine. 2021: 463-466.
[21] Zou X, Shi W L, Du M G, et al. A square cross-section FOV rotational CL (SC-CL) and its analytical reconstruction method. 2024.
[22] HAN Y, KIM J, YE J C. Differentiated backprojection domain deep learning for conebeam crtifact removal[J/OL]. IEEE transactions on medical imaging, 2020, 39(11): 3571-3582. DOI:10. 1109/TMI.2020.3000341.



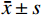
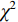
 下载:
下载: