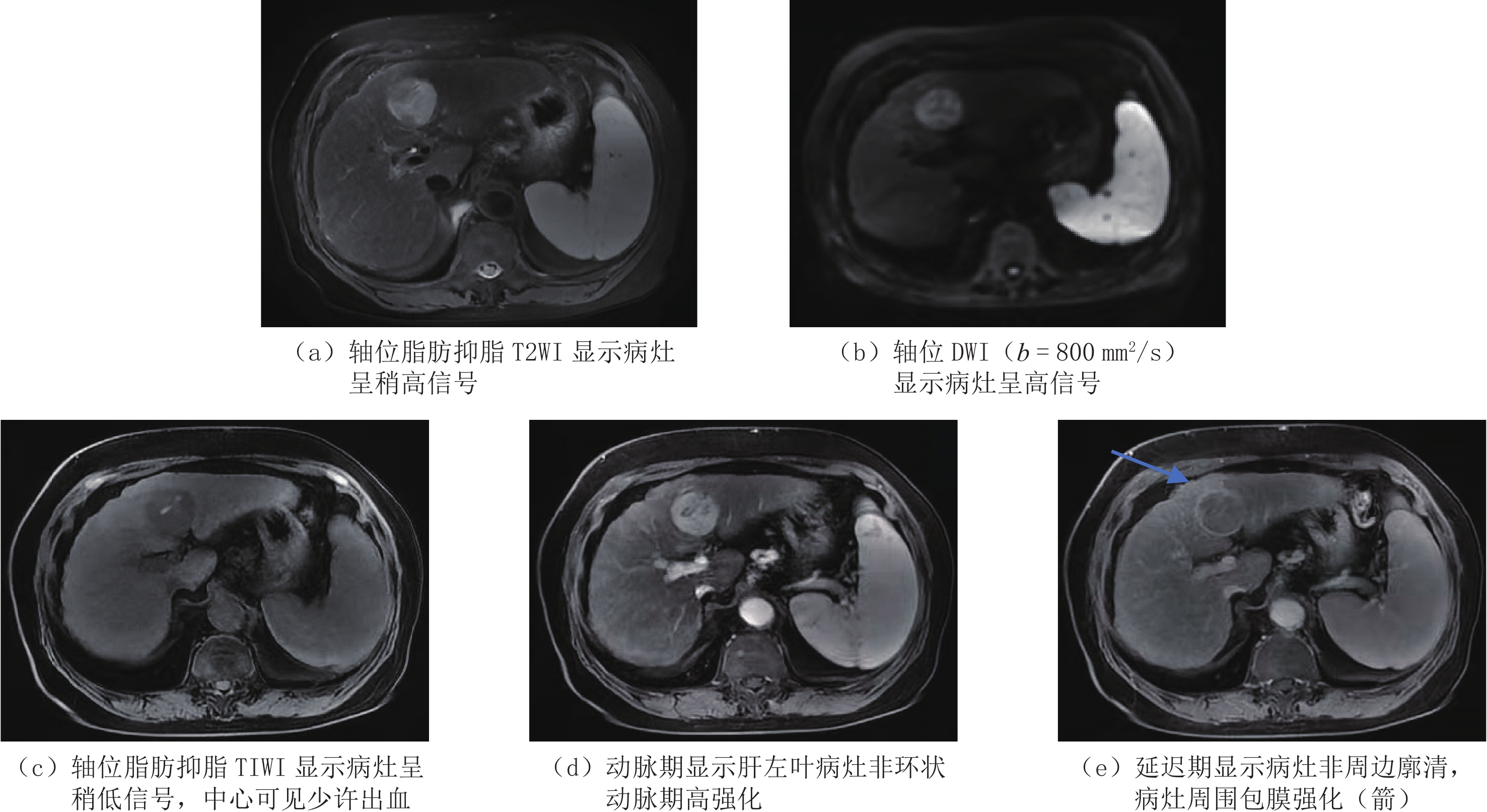
The Diagnostic Efficacy of Version 2018 LI-RADS for Hepatocellular Carcinoma on Enhanced Magnetic Resonance Imaging
-
摘要:
目的:探讨增强MRI采用2018版肝脏影像报告和数据系统(LI-RADS)在高危人群中对肝细胞癌(HCC)的诊断效能。方法:回顾性分析本院2017年至2022年经病理证实的69例HCC患者,并且行MRI增强检查。基于LI-RADS v2018,对每个病灶MRI图像的主要/辅助征象进行评价及LI-RADS分类。以病理结果为金标准,评价增强MRI采用LI-RADS v2018对HCC的诊断效能。采用组内相关系数(ICC)评价阅片者的一致性。结果:3位阅片者间LI-RADS分类的ICC值为0.782(95% 可信区间0.713~0.841)。基于LI-RADS v2018,以LR-5为诊断标准,MRI阅片者1诊断HCC的敏感度、特异度和准确率分别为83.9%、70.4% 和79.8%;阅片者2分别为80.6%、74.1% 和78.7%;阅片者3分别为80.6%、77.8%和79.8%。以LR-4联合LR-5为诊断标准,阅片者1诊断HCC的敏感度、特异度和准确率分别为93.5%、63.0% 和84.3%,阅片者2分别为90.3%、66.7% 和83.1%,阅片者3分别为91.9%、66.7%和84.3%。结论:基于LI-RADS v2018,增强MRI在高危人群中诊断HCC具有较高的诊断价值。
-
关键词:
- 磁共振成像 /
- 肝细胞癌 /
- 2018版肝脏成像报告和数据系统
Abstract:Objectives: To evaluate the diagnostic performance of the 2018 version of liver reporting and date system (LI-RADS v2018) for hepatocellular carcinoma (HCC) on contrast-enhanced magnetic resonance imaging (MRI) in high-risk patients. Methods: The data from 69 patients with HCC confirmed by pathology from 2017 and 2022 were retrospectively analyzed. The MRI features of the HCC lesions were analyzed and categorized according to LI-RADS v2018. The efficacy of LI-RADS v2018 in the diagnosis of HCC was calculated based on pathology. The intraclass correlation coefficient (ICC) test was used for consistency analysis. Results: The ICC value of the LI-RADS categories was 0.782 (95%CI: 0.713 to 0.841) across three readers based on the Liver Imaging Reporting and Data System (LI-RADS) criteria. When using LR-5 as the criterion to predict HCCs, the sensitivity, specificity and accuracy for each reader were 83.9%, 70.4%, and 79.8%; 80.6%, 74.1%, and 78.7%; and 80.6%, 77.8%, and 79.8%, respectively. When using LR-4/5 as the criterion to predict HCCs, these measures for each reader were 93.5%, 63.0%, and 84.3%; 90.3%, 66.7%, and 83.1%; and 91.9%, 66.7%, and 84.3%, respectively. Conclusion: Based on LI-RADS v2018, the enhanced MRI demonstrated high diagnostic efficacy for HCC in high-risk patients.
-
肝细胞癌(hepatocellular carcinomas,HCC)是全球最常见的恶性肿瘤,根据最新癌症报告统计结果,HCC 发病率居全球第6位,死亡率居全球第3位[1-2],因此,HCC的早期诊断对患者预后具有重要意义。影像学技术是诊断肝脏病变最重要的检查方法,对观察肝脏肿瘤的定位、定性等具有重要作用,尤其是MRI成像[3]。
为了规范和标准化肝脏影像术语、肝脏成像的图像采集、影像征象解读、报告和数据采集,2011年美国放射学会首次提出CT/MRI肝脏影像报告及数据系统(liver imaging reporting and data system,LI-RADS),它是一个动态的系统,在临床实践过程中,并依据影像知识的更新以及使用者的研究反馈分别于2014、2017及2018年进行了更新,2018年的更新旨在统一HCC影像学征象及影像诊断流程的肝脏影像报告及数据系统(LI-RADS v2018)[4-6],并被纳入美国肝脏疾病研究协会(the American Association for the Study of Liver Diseases,AASLD)2018年HCC临床实践指南[7]。LI-RADS v2018更新点主要针对阈值生长和LR-5分类标准进行修订和简化,更新了阈值增长概念、摒弃了LR-5g及LR-5us的分类,直接划分了病灶的分类,并对LI-RADS v2017发布以来使用者反馈的问题和可能产生异议的部分进行了阐述,且首次发布了详细的使用手册[8-10]。
有研究已经肯定了LI-RADS v2018对HCC的诊断价值,但增强MRI采用LI-RADS v2018对HCC的诊断效能尚有待更深入的研究。本研究旨在探讨基于LI-RADS v2018,增强MRI对HCC各种征象的识别率及诊断效能。
1. 资料与方法
1.1 临床资料
回顾性收集2017年1月至2022年12月本院经病理证实的具有HCC高危因素患者的临床、影像学检查及病理学资料。本研究经过伦理委员会讨论批准。所有受试者均签署MRI检查知情同意书。在分析之前,所有患者的基本信息都被匿名隐去。
纳入标准:①根据 2019年版《原发性肝癌诊疗规范》符合慢性肝病的临床诊断标准[11];②LI-RADS的适用人群(a.肝硬化患者;b.慢性病毒性肝炎患者;c.目前或曾经诊断HCC患者);③术前接受细胞外对比剂(extracellular contrast agent,ECA)增强的腹部MRI检查且扫描各期相准确。排除标准:①MRI检查前接受过手术、介入或者其他引起肝脏病变形态或代谢改变的治疗;②MRI图像扫描不符合LI-RADS v2018规范;③肝内病灶数目>3个。
最终本研究纳入69例患者,共89个病灶。男47例,女22例,中位年龄59岁(21~85岁)。
1.2 图像采集
MRI扫描采用3.0 T MRI扫描仪(GE Discovery 750 W),16通道体部相控阵线圈。检查前患者空腹4 h以上。常规扫描序列包括定位相、横断面和冠状面T2WI、同反相位横轴位T1WI及DWI(b值=0、800 s/mm2),序列层厚6 mm,间隔1.2 mm。动态增强扫描前静脉团注Gd-DTPA,剂量0.1 mmol/kg,注射速率2.0 ml/s。
在预扫描后,采用LAVA行肝脏动态增强扫描,分别在注射对比剂后采集动脉期(20~35 s)、门静脉期(70~80 s)及延迟期(3~5 min),层厚2~4 mm,无间隔。所有图像均满足LI-RADS v2018要求[7]。
1.3 图像分析
MRI图像均在图像存档和通信系统(Picture archiving and communication system,PACS)进行回顾性分析。由一位放射科医师查询临床资料、病理结果和影像学资料,记录每个病灶的位置(肝段)、测量大小(选择病灶显示最清楚的轴位或冠状位测量、并且尽可能不选择动脉期)和标注对应的图像编号。由3位高年资放射科医师(分别具有11年、10年和7年腹部诊断经验)进行独立盲法阅片。
根据LI-RADS v2018 CT/MRI分类标准进行阅片[7],分析主要征象及辅助征象进行评价。主要征象包括非环状动脉期高强化,非周边廓清,包膜强化和超阈值生长。辅助征象包括非强化包膜、结中结、马赛克结构、病灶含脂、病灶内出血、晕状强化、扩散受限、T2WI稍高信号、实性肿块乏铁、实性肿块乏脂、平行血池强化、非扭曲血管、T2WI显著高信号。此外,根据ACR提出的LI-RADS诊断算法对每个肝脏病变进行分类[7]:LR-1(肯定为良性)、LR-2(可能为良性)、LR-3(不确定)、LR-4(可能为HCC)、LR-5(肯定为HCC)、LR-M(可能或肯定为恶性,但不一定是HCC)。
1.4 统计学分析
使用SPSS 23.0软件包进行统计分析。符合正态分布的计量资料以(均数
$ \pm $ 标准差)表示,计数资料以百分比表示。分别以LR-5、LR-4联合LR-5作为HCC诊断标准,以病理结果为金标准,计算基于LI-RADS v2018分类标准,增强MRI对HCC的诊断效能。通过组内相关系数(intraclass correlation coefficient,ICC)评价阅片者的一致性:ICC
$ \le $ 0.5,一致性差;ICC为0.51~0.75,中等一致性;ICC为0.76~0.90,一致性较好;ICC>0.90,一致性很好。P<0.05为差异有统计学意义。2. 结果
2.1 病例特征
本研究最终纳入69例患者(共89个病灶),其中 HCC 62个,非HCC的其他恶性肿瘤11个(分别为肝内胆管细胞癌5个,肝细胞癌-胆管细胞混合癌1个,血管肉瘤1个,神经内分泌肿瘤1个,转移瘤-腺癌3个),良性病变16个(包括肝硬化不典型增生结节9个、海绵状血管瘤3个、局灶性结节增生(FNH)2个、平滑肌血管脂肪瘤2个)。
HCC和非HCC病灶的最大径分别为(3.17±1.68)cm和(3.11±1.83)cm。47个病灶经穿刺活检病理证实,42个病灶经手术病理证实。
2.2 病灶征象评价及一致性分析
不同阅片者对HCC主要征象和辅助征象的识别率及一致性评价见表1。在主要征象中,非环状动脉期高强化(77.5%、74.2%、79.8%)和非周边廓清征象(68.5%、65.2%、70.8%)具有较高的识别率(图1),此两种主要征象的识别率一致性表现为较好(ICC=0.848、0.877),与其他2个主要征象相比,强化包膜的识别率(49.4%、60.7%、56.2%)相对较低,一致性表现为中等(ICC=0.646)。
表 1 不同阅片者LI-RADS v2018的主要和辅助征象及一致性评价结果Table 1. The result of inter-reader agreement and recognition rate of LI-RADS v2018 featuresMRI征象 识别率(%) ICC值
(95%可信区间)阅片者1 阅片者2 阅片3 主要征象 非环状动脉期高强化 69(77.5) 66(74.2) 71(79.8) 0.877(0.830~0.913) 非周边廓清 61(68.5) 58(65.2) 63(70.8) 0.848(0.793~0.892) 包膜强化 44(49.4) 54(60.7) 50(56.2) 0.646(0.542~0.737) 辅助征象 扩散受限 82(92.1) 79(88.8) 80(89.9) 0.875(0.829~0.912) T2 WI稍高信号 81(91.0) 76(85.4) 78(87.6) 0.794(0.722~0.852) 马赛克结构 42(47.2) 45(50.6) 40(44.9) 0.657(0.555~0.746) 病灶内含脂 21(23.6) 15(16.9) 25(28.1) 0.637(0.532~0.730) 非强化包膜 13(14.6) 15(16.9) 10(11.2) 0.236(0.106~0.376) 结节中结节 13(14.6) 12(13.5) 10(11.2) 0.607(0.497~0.706) 病灶内出血 11(12.4) 13(14.6) 10(11.2) 0.699(0.605~0.779) 晕状强化 5(5.6) 3(3.4) 2(2.3) 0.277(0.145~0.416) 实性肿块乏铁 1(1.1) 0(0.0) 0(0.0) NA 实性肿块乏脂 0(0.0) 3(3.4) 0(0.0) NA 平行于肝血池强化 0(0.0) 0(0.0) 2(2.3) NA T2WI显著高信号 2(2.3) 1(1.1) 0(0.0) NA 注:NA表示一位或两位医师未观察到此征象。 辅助征象中扩散受限(92.1%、88.8%、89.9%)及T2WI稍高信号(91.0%、85.4%、87.6%)的识别率最高(图1),阅片者的一致性表现为较好(ICC=0.794、0.875),其次是马赛克征象的识别率相对较高(图2)。
其他辅助征象中除了晕状强化及非强化包膜的阅片者一致性差(ICC=0.236、0.277),余辅助征象的识别率均为中等一致性(ICC=0.607~0.699)。
2.3 基于LI-RADS v2018分类结果及诊断效能
根据LI-RADS v2018诊断流程,3位阅片者对89个病灶的分类结果见表2。其中85.1% 的病灶分类为LR≥4(即LR-4、5、M)。3位阅片者对病灶分类的一致性较好(ICC=0.782,95%可信区间0.713~0.841)。
表 2 3位阅片者对病灶的分类结果(个)Table 2. The three readers’ results of the classified lesions (n)阅片者 LI-RADS分类结果 合计 LR≤3(%) LR-4(%) LR-5(%) LR-M(%) 阅片者1 13(14.6) 12(13.5) 60(67.4) 4(4.5) 89 阅片者2 14(15.7) 13(14.6) 57(64.1) 5(5.6) 89 阅片者3 13(14.6) 13(14.6) 56(62.9) 7(7.9) 89 平均 13.3(14.9) 12.7(14.2) 57.7(64.8) 5.3(6.0) 89 以病理结果为金标准,将LR-5病灶作为HCC诊断标准,3名阅片者诊断HCC的敏感度为80.6%~83.9%,特异度为70.4%~77.8%,准确率为78.7%~79.8%,阳性预测值为86.7%~89.3%,阴性预测值为62.5%~65.5%;将LR-4联合LR-5作为HCC诊断标准,敏感度为90.3%~93.5%,特异度为63.0%~66.7%,准确率为83.1%~84.3%,阳性预测值为85.3%~86.4%,阴性预测值为75.0%~81.0%(表3)。
表 3 3位阅片者根据2018版LI-RADS诊断HCC的效能Table 3. The efficacy of three readers’in diagnosing HCC based on LI-RADS v2018阅片者 参考标准 敏感度/% 特异度/% 阳性预测值/% 阴性预测值/% 准确率/% 医师1 LR-5 0.839(52/62) 0.704(19/27) 0.867(52/60) 0.655(19/29) 0.798(71/89) LR-4+LR-5 0.935(58/62) 0.630(17/27) 0.853(58/68) 0.810(17/21) 0.843(75/89) 医师2 LR-5 0.806(50/62) 0.741(20/27) 0.877(50/57) 0.625(20/32) 0.787(70/89) LR-4+LR-5 0.903(56/62) 0.667(18/27) 0.862(56/65) 0.750(18/24) 0.831(74/89) 医师3 LR-5 0.806(50/62) 0.778(21/27) 0.893(50/56) 0.636(21/33) 0.798(71/89) LR-4+LR-5 0.919(57/62) 0.667(18/27) 0.864(57/66) 0.783(18/23) 0.843(75/89) 3. 讨论
本组研究结果显示,基于LI-RADS v2018,增强MRI对HCC的主要征象及大部分辅助征象均具有较高的识别率,并且对主要征象的一致性评价表现为较好,对大部分辅助征象表现为较好至中等一致性。以LR-5分类标准作为HCC诊断标准,对HCC诊断的特异度较高;以LR-4联合LR-5分类标准作为HCC诊断标准,对HCC的诊断敏感度有所提高。
3.1 增强MRI对各种征象的识别率
LI-RADS采用主要征象对肝内病变分类以反映病变为HCC的可能性。主要征象中的非环状动脉期高强化及非周边廓清是进展期HCC的特征表现,两者是LI-RADS v2018诊断的核心征象,主要用于区分HCC与其他非HCC恶性病变的强化特点[12]。本研究结果也证实两者在MRI上具有较高的识别率,并且在阅片者中具有较好一致性;另一个重要的主要征象是包膜样强化,与其他两种主要征象相比,此征象在MRI中的识别率相对较低,考虑原因可能与纤维组织的缓慢强化有关。
在2017年之前的LI-RADS CT/MRI版本中,辅助征象在肝脏病变中的诊断中是必须使用的,为降低LI-RADS的复杂性,在2017版和2018版本中则由放射科医师根据自身的经验选择应用,但很多研究已经证实各个辅助征象对诊断HCC的权重和价值[13-16],其中T2WI稍高信号和扩散受限是MRI独有的辅助征象,两者是HCC与肝脏其他再生结节的主要鉴别点[17-18]。本研究结果也证实扩散成像和T2WI稍高信号在辅助征象中具有较高的识别率和较好的一致性。
另外,其他各个辅助征象对诊断HCC的权重和价值尚有争议。据文献[13]报道,马赛克结构、非强化包膜和结节中结节是HCC特异的恶性辅助征象,其中马赛克结构在HCC中识别率相对较高,与HCC的关系最密切。本研究结果与上述文献报道的结果有一定的一致性,但也存在部分差异,考虑原因可能与不同研究纳入病变的构成比例不同有关,也可能是由于使用不同对比剂所导致的差异。
3.2 基于LI-RADS v2018增强MRI对HCC诊断效能
既往研究指出LI-RADS v2018对HCC的诊断有较高的敏感度和特异度[19-20]。本研究分别以LR-4+LR-5及LR-5的病灶作为HCC诊断标准进行了诊断效能的评价,研究结果表明LR-5诊断HCC的敏感度分别为80.6%、80.6%和83.9%,LR-4联合LR-5诊断HCC的敏感度分别为90.3%、91.9%和93.5%,由LR-5到LR4+LR-5作为HCC的诊断标准,其诊断HCC的敏感度有所提高,这主要可能是因为辅助征象增加了诊断HCC的信心,通常辅助征象可以将LR-3类升到LR-4类,而对LR-4类的病变辅助征象并无过多的参考价值。
本研究结果证实扩散成像、T2 WI稍高信号和马赛克征象对HCC的识别率相对较高,这增加了诊断HCC的敏感性且保留了相对高特异性[21],所以如果为了提高HCC诊断的敏感度,需要提升辅助征象对HCC的诊断权重。但选取LR-4联合LR-5的病灶作为HCC的诊断标准,这样会相对降低诊断病灶的特异度。因此,针对各个地方的区域差异性,如亚洲地区,尤其是中国乙肝肝硬化的高发病率,HCC诊断的高敏感性应是我国重点关注的核心,可首选LR-4联合LR-5作为诊断HCC的评价方法,提高其诊断的敏感度;在以欧美为代表的西方地区通常选择肝移植为主要治疗手段,这需要与组织病理学诊断相当的高特异度才可以最大程度利用移植器官,避免分配给误诊的HCC患者。根据不同需求采用不同的LI-RADS分类标准,可以有效的提高MRI诊断HCC的敏感度和特异度,有利于指导临床更准确的做出诊断,及早治疗,进而提高生存率。
本研究的局限性。首先,由于大多数病例在检查后即行外科治疗,因此本研究未分析病灶的超阈值增长;其次,本研究为回顾性研究,选择研究对象可能存在选择性偏倚。
综上所述,基于2018版肝脏影像报告及数据系统,增强MRI对HCC主要/大部分辅助征象的识别率及一致性较好,并且对HCC具有较高的诊断价值。因此,本研究为LI-RADS v2018进一步的更新提供了依据,有利于临床应用。
-
表 1 不同阅片者LI-RADS v2018的主要和辅助征象及一致性评价结果
Table 1 The result of inter-reader agreement and recognition rate of LI-RADS v2018 features
MRI征象 识别率(%) ICC值
(95%可信区间)阅片者1 阅片者2 阅片3 主要征象 非环状动脉期高强化 69(77.5) 66(74.2) 71(79.8) 0.877(0.830~0.913) 非周边廓清 61(68.5) 58(65.2) 63(70.8) 0.848(0.793~0.892) 包膜强化 44(49.4) 54(60.7) 50(56.2) 0.646(0.542~0.737) 辅助征象 扩散受限 82(92.1) 79(88.8) 80(89.9) 0.875(0.829~0.912) T2 WI稍高信号 81(91.0) 76(85.4) 78(87.6) 0.794(0.722~0.852) 马赛克结构 42(47.2) 45(50.6) 40(44.9) 0.657(0.555~0.746) 病灶内含脂 21(23.6) 15(16.9) 25(28.1) 0.637(0.532~0.730) 非强化包膜 13(14.6) 15(16.9) 10(11.2) 0.236(0.106~0.376) 结节中结节 13(14.6) 12(13.5) 10(11.2) 0.607(0.497~0.706) 病灶内出血 11(12.4) 13(14.6) 10(11.2) 0.699(0.605~0.779) 晕状强化 5(5.6) 3(3.4) 2(2.3) 0.277(0.145~0.416) 实性肿块乏铁 1(1.1) 0(0.0) 0(0.0) NA 实性肿块乏脂 0(0.0) 3(3.4) 0(0.0) NA 平行于肝血池强化 0(0.0) 0(0.0) 2(2.3) NA T2WI显著高信号 2(2.3) 1(1.1) 0(0.0) NA 注:NA表示一位或两位医师未观察到此征象。 表 2 3位阅片者对病灶的分类结果(个)
Table 2 The three readers’ results of the classified lesions (n)
阅片者 LI-RADS分类结果 合计 LR≤3(%) LR-4(%) LR-5(%) LR-M(%) 阅片者1 13(14.6) 12(13.5) 60(67.4) 4(4.5) 89 阅片者2 14(15.7) 13(14.6) 57(64.1) 5(5.6) 89 阅片者3 13(14.6) 13(14.6) 56(62.9) 7(7.9) 89 平均 13.3(14.9) 12.7(14.2) 57.7(64.8) 5.3(6.0) 89 表 3 3位阅片者根据2018版LI-RADS诊断HCC的效能
Table 3 The efficacy of three readers’in diagnosing HCC based on LI-RADS v2018
阅片者 参考标准 敏感度/% 特异度/% 阳性预测值/% 阴性预测值/% 准确率/% 医师1 LR-5 0.839(52/62) 0.704(19/27) 0.867(52/60) 0.655(19/29) 0.798(71/89) LR-4+LR-5 0.935(58/62) 0.630(17/27) 0.853(58/68) 0.810(17/21) 0.843(75/89) 医师2 LR-5 0.806(50/62) 0.741(20/27) 0.877(50/57) 0.625(20/32) 0.787(70/89) LR-4+LR-5 0.903(56/62) 0.667(18/27) 0.862(56/65) 0.750(18/24) 0.831(74/89) 医师3 LR-5 0.806(50/62) 0.778(21/27) 0.893(50/56) 0.636(21/33) 0.798(71/89) LR-4+LR-5 0.919(57/62) 0.667(18/27) 0.864(57/66) 0.783(18/23) 0.843(75/89) -
[1] LEE J, CHANG J I, JIN Y J, et al. Recurrence of hepatoccellular carcinoma in noncirrhotic patients with nonalcoholic fatty liver disease versus hepatitis B infection[J]. European Journal of Gastroenterology & Hepatology,2023 ,35 (4 ):431 −439 .LEE J, CHANG J I, JIN Y J, et al. Recurrence of hepatoccellular carcinoma in noncirrhotic patients with nonalcoholic fatty liver disease versus hepatitis B infection[J]. European Journal of Gastroenterology & Hepatology,2023,35(4): 431−439.
[2] PSILOPATIS I, DAMASKOS C, GARMPI A, et al. FDA-Apporoved monoclonal antibodies for unresectable hepatocellular carcinoma: What do we know so far?[J]. International Journal of Molecular Sciences, 2023, 24(3): 2685.
[3] MARRERO J A, KULIK L M, SIRLIN C B, et al. Diagnosis, staging, and management of hepatocellular carcinoma: 2018 practice guidance by the American Association for the study of liver diseases[J]. Hepatology, 2018, 68(2): 723−750. DOI: 10.1002/hep.29913.
[4] POMFRET E, WASHBURN K, WALD C, et al. Report of a national conference on liver allocation in patients with hepatocellular carcinoma in the United States[J]. Liver Transplant, 2010, 16(3): 262−278. DOI:10. 1002/lt.21999.
[5] American College of Radiology. CT/MRI Liver Imaging Reporting and Data System version 2014[EB/OL]. https://www.acr.org/media/ACR/Files/Clinical-Resources/LIRADS/LI-RADS-2014-Flash-Cards.pdf.
[6] American College of Radiology. CT/MRI Liver Imaging Reporting and Data System version 2017[EB/OL]. https://www.acr.org/Clinical-Resources/Reporting-and-Data-Systems/LI-RADS/CT-MRI- LI-RADS-v2017.
[7] American College of Radiology. CT/MRI liver imaging reporting and data system version 2018[EB/OL]. https://www.acr.org/Clinical-Resources/Reporting-and-Data-System/LI-RADS/CT-MRI-LI-RADS-v2018.
[8] HANLON C A, DOWDLE L T, MOSS H, et al. Mobilization of medial and lateral frontal-striatal circuits in cocaine users and controls: An interleaved TMS/BOLD functional connectivity study[J]. Neuropsychopharmacol, 2016, 41(13): 3032−3041. DOI: 10.1038/npp.2016.114.
[9] LI X, DU L, SAHLEM G L, et al. Repetitive transcranial magnetic stimulation (rTMS) of the dorsolateral prefrontal cortex reduces resting-state insula activity and modulates functional connectivity of the orbitofrontal cortex in cigarette smokers[J]. Drug Alcohol Depen, 2017, 174: 98−105. DOI: 10.1016/j.drugalcdep.2017.02.002.
[10] SU H, LIU Y, YIN D, et al. Neuroplastic changes in resting-state functional connectivity after rTMS intervention for methamphetamine craving[J]. Neuropharmacology, 2020, 175: 108177. DOI: 10.1016/j.neuropharm.2020.108177.
[11] 中华人民共和国国家卫生健康委员会医政医管局. 原发性肝癌诊疗规范(2019年版)[J]. 临床肝胆病杂志,2020,36(2): 277−292. DOI: 10.3969/j.issn.1001-5256.2020.02.007. [12] JEON S, JOO I, LEE D, et al. Combined hepatocellular cholangiocarcinoma: LI-RADS v2017 categorisation for differential diagnosis and prognostication on gadoxetic acid-enhanced MR imaging[J]. European Journal of Radiology, 2019, 29(1): 373−382. DOI: 10.1007/s00330-018-5605-x.
[13] REN A H, ZHAO P F, YANG D W, et al. Diagnostic performance of MR for hepatocellular carcinoma based on LI-RADS v2018, compared with v2017[J]. Journal of Magnetic Resonance Imaging, 2019, 50(3): 746−755. DOI: 10.1002/jmri.26640.
[14] KANG J H, CHOI S H, BYUN J H, et al. Ancillary features in the liver imaging reporting and data system: How to improve diagnosis of hepatocellular carcinoma
$ \le $ 3 cm on magnetic resonance imaging[J]. European Journal of Radiology, 2020, 30(5): 2881−2889. DOI: 10.1007/s00330-019-06645-3.[15] GAETANO A M D, CATALANO M, POMPILI M, et al. Critical analysis of major and ancillary features of LI-RADS v2018 in the differentiation of small (
$ \le $ 2 cm) hepatocellular carcinoma from dysplastic nodules with gadobenate dimeglumine-enhanced magnetic resonance imaging[J]. European Review for Medical and Pharmacological Sciences, 2019, 23(18): 7786−7801.[16] CERNY M, BERGERON C, BILLIARD J S, et al. LI-RADS for MR imaging diagnosis of hepatocellular carcinoma: Performance of major and ancillary features[J]. Radiology, 2018, 288(1): 118−128. DOI: 10.1148/radiol.2018171678.
[17] CERNY M, CHERNYAK V, OLIVIE D, et al. LI-RADS version 2018 ancillary features at MRI[J]. Radiographics, 2018, 38(7): 1973−2001. DOI: 10.1148/rg.2018180052.
[18] Van der WERF Y D, SANZ-ARIGITA E J, MENNING S, et al. Modulating spontaneous brain activity using repetitive transcranial magnetic stimulation[J]. BioMed Central Neuroscience, 2010, 11(1): 145. DOI:10. 1186/1471-2202-11-145.
[19] OCKER M, MAYR C, KIESSLICH T, et al. Immunmodulatory treatment strategies of hepatocellular carcinoma: From checkpoint inhibitors now to an integrated approach in the future[J]. Cancers, 2021, 13(7): 1558.
[20] CHAUDHARI V, KHOBRAGADE K, BHANDARE M, et al. Management of fibrolamellar hepatocellular carcinoma[J]. Chinese Clincal Oncology, 2018, 7(5): 51. DOI: 10.21037/cco.2018.08.08.
[21] AN C, KIM M. Imaging features related with prognosis of hepatocellular carcinoma[J]. Abdominal Radiology (NY), 2019, 44(2): 509−516. DOI: 10.1007/s00261-018-1758-y.



 下载:
下载: