Application Value of Normalized Apparent Diffusion Coefficient and Prostate-specific Antigen Density for Prostate Imaging Reporting and Data System Category 3 Lesions in the Prostate-specific Antigen Gray Zone
-
摘要:
目的:探讨当血清PSA处于4~10 ng/mL时,标准化表观扩散系数ADCn、前列腺特异性抗原密度PSAD在2.1版前列腺影像报告和数据系统(PI-RADS v2.1)评分3分病灶中的应用价值。方法:选取2018年1月至2022年6月经病理证实的58例PI-RADS v2.1评分为3分患者,PSA值均为4~10 ng/mL。根据病理结果分为PCa组(20例)和非PCa组(38例)。收集患者的临床资料,包括年龄、前列腺特异性抗原PSA、前列腺体积PV,通过公式计算PSAD(PSAD=PSA/V);同时于ADC图像上测量病变区及外周带正常组织的表观扩散系数值ADC,并计算标准化表观扩散系数值,即ADCn(ADC病灶/ADC外周带)。比较ADCn、PSAD在两组间差异是否具有统计学意义,采用受试者工作特性曲线(ROC)比较二者对 PI-RADS v2.1评分3分病灶中PCa的诊断效能。结果:年龄、PSA在两组间差异无统计学意义;PCa组的ADCn小于非PCa组(0.52 vs. 0.69),PCa组的PSAD大于非PCa组(0.28 vs. 0.18)。ADCn、PSAD诊断PCa的ROC曲线下面积 AUC、敏感度、特异度分别为0.849、85.2%、81.6%,0.813、85.0%、78.4%,ADCn表现的效能较高。当二者联合应用取最佳诊断阈值0.373时,诊断PCa的AUC为0.962,敏感度90.0%、特异度89.5%。结论:ADCn、PSAD能够辅助PSA灰区时PI-RADS v2.1评分3分病灶中PCa的检出,二者联合应用可明显提高诊断敏感性和特异性。
-
关键词:
- 扩散系数 /
- 前列腺癌 /
- 前列腺特异性抗原密度 /
- PSA灰区
Abstract:Objective: To investigate the application value of normalized apparent diffusion coefficient (ADC) values and prostate-specific antigen density (PSAD) in category 3 Prostate Imaging Reporting and Data System (PI-RADS) version 2.1 lesions when the serum prostate-specific antigen (PSA) level is in the grey zone of 4~10 ng/mL. Methods: From January 2018 to June 2022, 58 patients with PI-RADS v2.1 scores of 3 and PSA values of 4~10 ng/mL were selected. According to the pathological results, the patients were divided into the PCa (20 cases) and non-PCa (38 cases) groups. The clinical data of the patients were collected, including age, PSA, prostate volume (PV), and PSAD (PSA/V) calculated by formula. Meanwhile, the ADC values of the lesion area and the normal tissue in the peripheral zone were measured on the ADC image, and the standardized apparent diffusion coefficient value was calculated, namely ADCn (ADC lesion/ADC peripheral zone). Statistical software was used to determine the statistical significance of the differences of ADCn and PSAD between the two groups. Receiver operating characteristic (ROC) curves were used to compare the diagnostic efficacy of the two for PCa in lesions with PI-RADS v2.1 score of 3. Results: Age and PSA did not differ significantly between the two groups. Compared to the non-PCa group, the PCa group showed lower ADCn (0.52 vs. 0.69) and higher PSAD (0.28 vs. 0.18). The area under the ROC curve (AUC), sensitivity, and specificity of ADCn and PSAD in the diagnosis of PCa were 0.849, 85.2%, and 81.6 % and 0.813, 85.0%, and 78.4%, respectively. For an optimal diagnostic threshold of 0.373, the AUC, sensitivity, and specificity of PCa were 0.962, 90.0%, and 89.5%, respectively. Conclusions: ADCn and PSAD can assist in PCa detection in lesions category 3 PI-RADS v2.1 lesions in the PSA gray area. The combination of ADCn and PSAD can significantly improve the diagnostic sensitivity and specificity.
-
Keywords:
- diffusion coefficient /
- prostate cancer /
- antigen density /
- PSA grey zone
-
前列腺癌(prostate cancer,PCa)是男性最常见的恶性肿瘤之一,已成为了全球范围内影响男性健康问题的疾病。近年来,我国前列腺癌的发病率有逐年上升的趋势,并且已证实超过了欧美等国家[1]。血清前列腺特异性抗原(prostate specific antigen,PSA)是PCa常用的筛查工具。由于PSA为4~10 ng/mL时,PCa与前列腺增生(benign prostate hyperplasia,BPH)存在很大程度上的重叠,有文献报道[2]此区间 PCa的穿刺检出率仅为20%~30%,在鉴别诊断上存在诸多挑战。因此,如何无创性的提高PSA灰区(PSA值处于4~10 ng/mL时)前列腺癌的检出率,避免不必要的穿刺活检,已成为临床关注热点。
2019年欧洲泌尿生殖协会联合美国放射协会在对第二版前列腺影像报告与数据系统(prostate imaging-reporting and data system version 2.0,PI-RADS v2.0)进一步细化修订的基础上,推出了PI-RADS v2.1,提高了多参数磁共振(multiparametric magnetic resonance imaging,mpMRI)对PCa的诊断准确性[3]。但是对于PI-RADS 3分的病灶是否进行穿刺活检仍然没有明确的指导意见,临床决策陷入两难境地,有研究报道[4],在前列腺PI-RADS 3分病灶穿刺活检的阴性率达到了67%。前列腺特异性抗原密度(prostate specific antigen density,PSAD)被认为可以较好的为评估PI-RADS 3分患者的患癌风险提供参考依据[5]。
表观扩散系数(apparent diffusion coefficient,ADC)通过对水分子扩散的扩散程度进行定量分析,在前列腺癌的诊断中得到了较好的应用。由于ADC值会因扫描条件的不同而改变,近年来,有研究者提出了标准化ADC值(normalized ADC,ADCn)的概念[6],认为可以避免患者本身及扫描技术条件(如b值)对ADC绝对值产生的影响。鉴于PSA灰区时PI-RADS v2.1评分3分病灶诊断的不确定性,本研究旨在探讨ADCn、PSAD对良、恶性病变鉴别诊断价值。
1. 资料与方法
1.1 一般资料
回顾性收集2018年1月至2022年6月经连云港市第二人民院病理证实的58例前列腺疾病患者临床和MRI影像资料。
纳入标准:①患者术前均行完善的 MRI检查,检查序列包括磁共振常规序列T1WI、T2WI、动态对比增强磁共振成像(dynamic contrast-enhanced magnetic resonance imaging,DCE-MRI)、DWI,PI-RADS v2.1评分为3分;②病理结果在 MRI检查后2周内获得,并且具备明确的Gleason评分分级;③患者在 MRI检查前均未接受任何相关治疗;④PSA值为4~10 ng/mL。排除标准:①患者MRI检查不完善或者图像质量不佳无法进行PI-RADS评分及测量ADC值;②前列腺增生明显导致外周带显示不清;③患者检查前接受相关治疗;④临床、病理资料不完善。最终入组患者58例,年龄48~86岁,平均(67.8±8.6)岁。
患者及家属均知情同意,且签署知情同意书;本研究经连云港市第二人民医院医学伦理委员会批准,伦理审查号LW2023001。
1.2 检查设备和方法
患者术前所有MRI检查在3.0 T MRI机器上进行(SIEMENS syngo MRI E11)。检查前嘱患者尽量清洁肠道内容物,以避免肠腔内容物影响图像质量,适量饮水充盈膀胱。取仰卧位,选择腹部线圈。扫描的上下范围包括前列腺、精囊腺和盆腔结构。均行轴位、矢状位、冠状位高分辨T1WI、T2WI、高b值 DWI(b值取 0,1500 s/mm2)。
表1为扫描序列及参数。DCE动态扫描时肘静脉注射钆喷酸葡胺(Gd-DTPA)20 mL,流率3.0 mL/s,采用3D-VIBE序列。
表 1 前列腺MRI扫描具体参数Table 1. Specific parameters of prostate MRI scans扫描序列 TR/ms TE/ms Fov/mm 层厚/mm 矩阵 层间距/mm 横断位T1WI 850 20 250×220 4 224×380 1 横断位T2WI 4000 110 250×220 4 224×380 1 矢状位T2WI 3000 110 240×220 4 240×160 1 横断位DWI 6000 76 290×240 4 128×128 1 DCE-MRI 5.28 1.35 220×220 4 240×330 1 1.3 图像处理和数据分析
由两名10年以上工作经验的腹部MRI诊断副主任医师在不知道患者临床信息和病理结果的情况下分别对病灶进行独立诊断和定位,给出PI-RADS评分,若结果不一致时由两位医师分析讨论达成共同意见后再进行评分。参照高分辨T1WI、T2WI、DWI图像,在工作站自动生成的ADC图像上手动勾画感兴趣区(region of interest,ROI),测量ADC值。具体方法如下:
①在病变最可疑区域的横轴位最大层面选择感兴趣区(小于病变的范围,且避开出血、钙化、囊变区),并测量其ADC值,定义为ADC病灶。②选取同侧或对侧正常外周带组织设置感兴趣区,需避开病灶侵犯及中央带与外周带结合区域,测量ADC值,定义为ADC外周带。根据所得结果计算出标准化ADC值,即ADCn=ADC病灶/ADC外周带;按照上述方法分别测量3次,取其平均值。
以上所选ROI均分别取病灶或前列腺外周带3个不同部位,范围大致保持一致。在高分辨率T2WI图像上测量前列腺体积,范围为前列腺底部至尖部,轴位图像上测量最大左右径LR和最大前后径AP,矢状位图像上测量前列腺最长上下径CC,根据长椭圆形公式[7]得出相应的前列腺体积V(cm3),即V=CC×AP×LR×0.52,然后根据患者的血清tPSA值,计算PSAD=tPSA/V。
1.4 病理学资料分析
所有患者病理标本经前列腺癌根治术或穿刺获得,由经验丰富的病理医师进行常规病理检查和免疫组织化学检查,进行病理诊断并记录病理结果,最终由病理科主任医师对结果进行审核。
1.5 统计学分析
应用SPSS 25.0统计分析软件。采用K-S检验各观察指标是否符合正态分布。采用独立样本t检验与秩和检验分别对符合正态分布和非正态分布的计量资料进行分析,比较各观察指标在PCa和非PCa组间差异是否具有统计学意义(P<0.05为差异有统计学意义)。采用MedCalc软件绘制ADCn、PSAD及两者联合应用鉴别前列腺癌的受试者工作特征曲线(ROC),获取曲线下面积(AUC),在最佳诊断阈值下,计算相应的诊断灵敏度、特异度;采用Z检验比较各AUC之间差异。
2. 结果
2.1 入组观察指标及单因素统计分析结果
入组患者经病理结果确定为PCa 20例,非PCa 38例。年龄、PSA符合正态分布,ADCn、PSAD不符合正态分布。独立样本t检验和秩和检验结果显示ADCn、PSAD在PCa组和非PCa组间差异具有统计学意义,ADCn值:PCa组<非PCa组;PSAD值:PCa组>非PCa组;两组间年龄和PSA差异无统计学意义(表2)。
表 2 各变量在PCa组和非PCa组间差异比较Table 2. Comparison of the differences in variables between the PCa and non-PCA groups项目 组别 统计检验 PCa组 非PCa组 t/Z P 例数 20 38 − − 年龄/岁 67.60±10.78 67.84±7.37 -0.101 0.021 PSA/(ng/mL) 7.15±2.17 6.39±1.75 1.45 0.052 PSAD/(ng/mL·cm3) 0.28(0.23,0.31) 0.18(0.14,0.24) -3.89 <0.001 ADCn 0.52(0.47,0.57) 0.69(0.64,0.78) -4.36 <0.001 注:表中括号内数字为第 25 百分位数和第 75 百分位数。 2.2 ADCn、PSAD对PI-RADS 3分病灶PCa的诊断效能结果
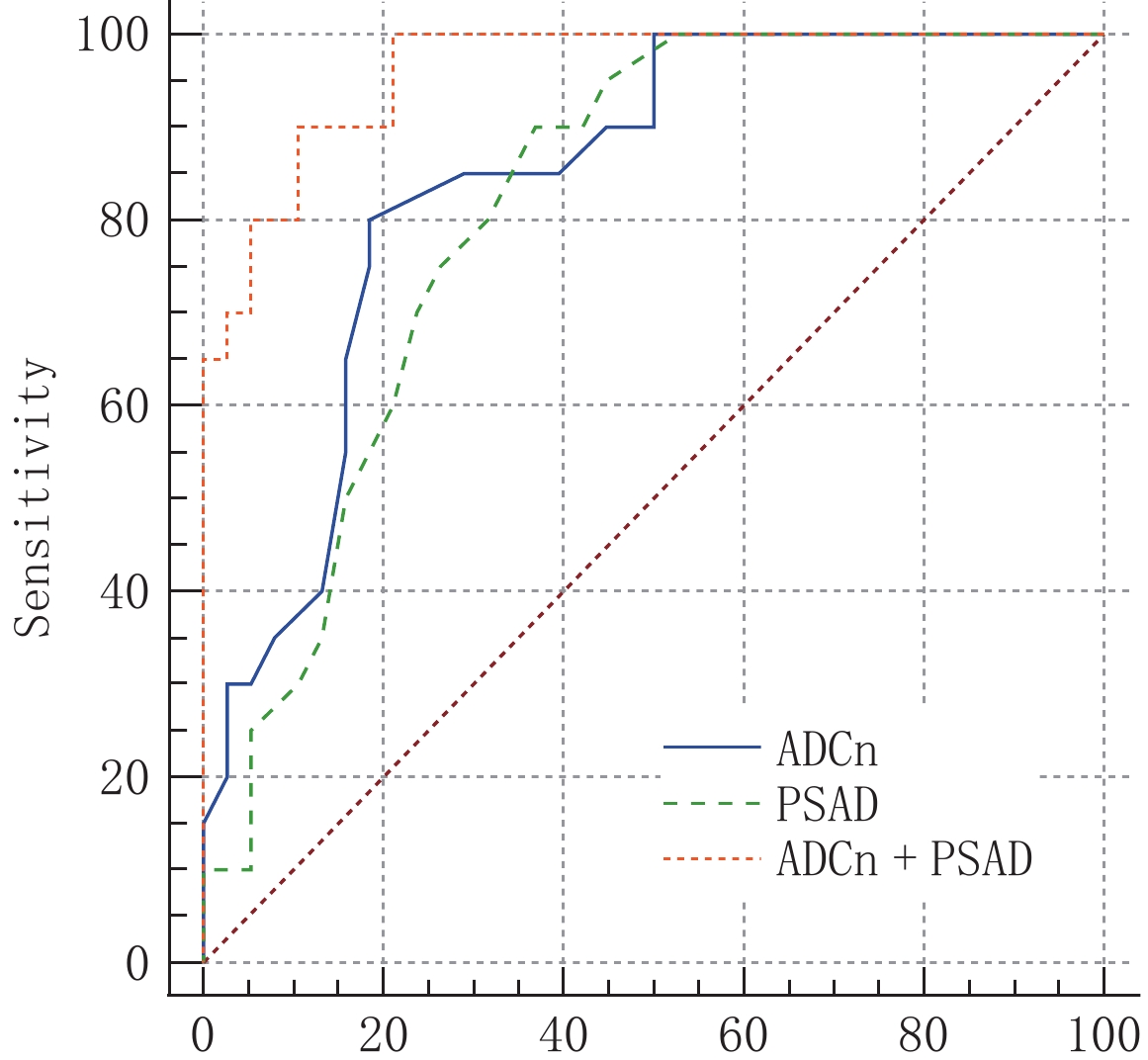
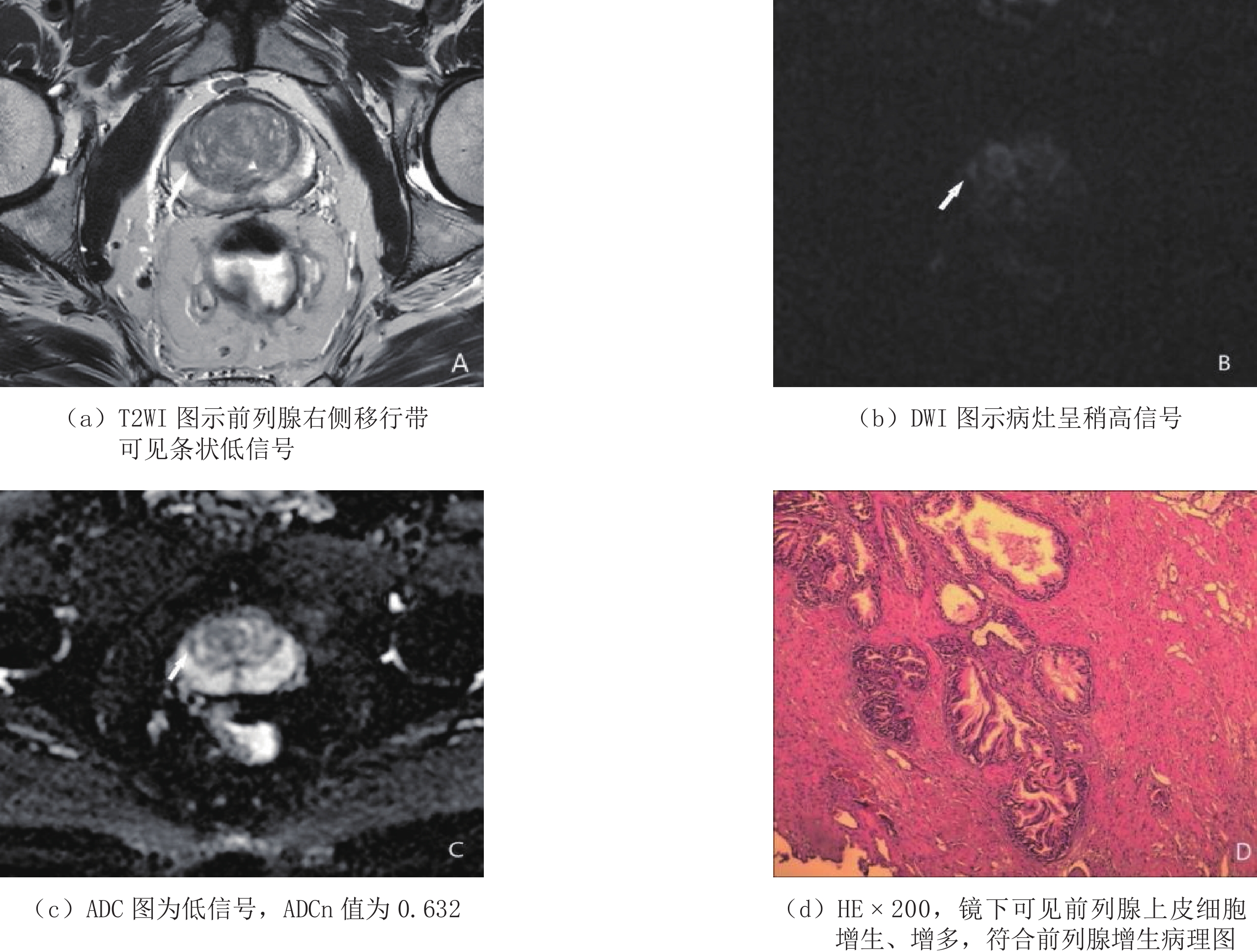
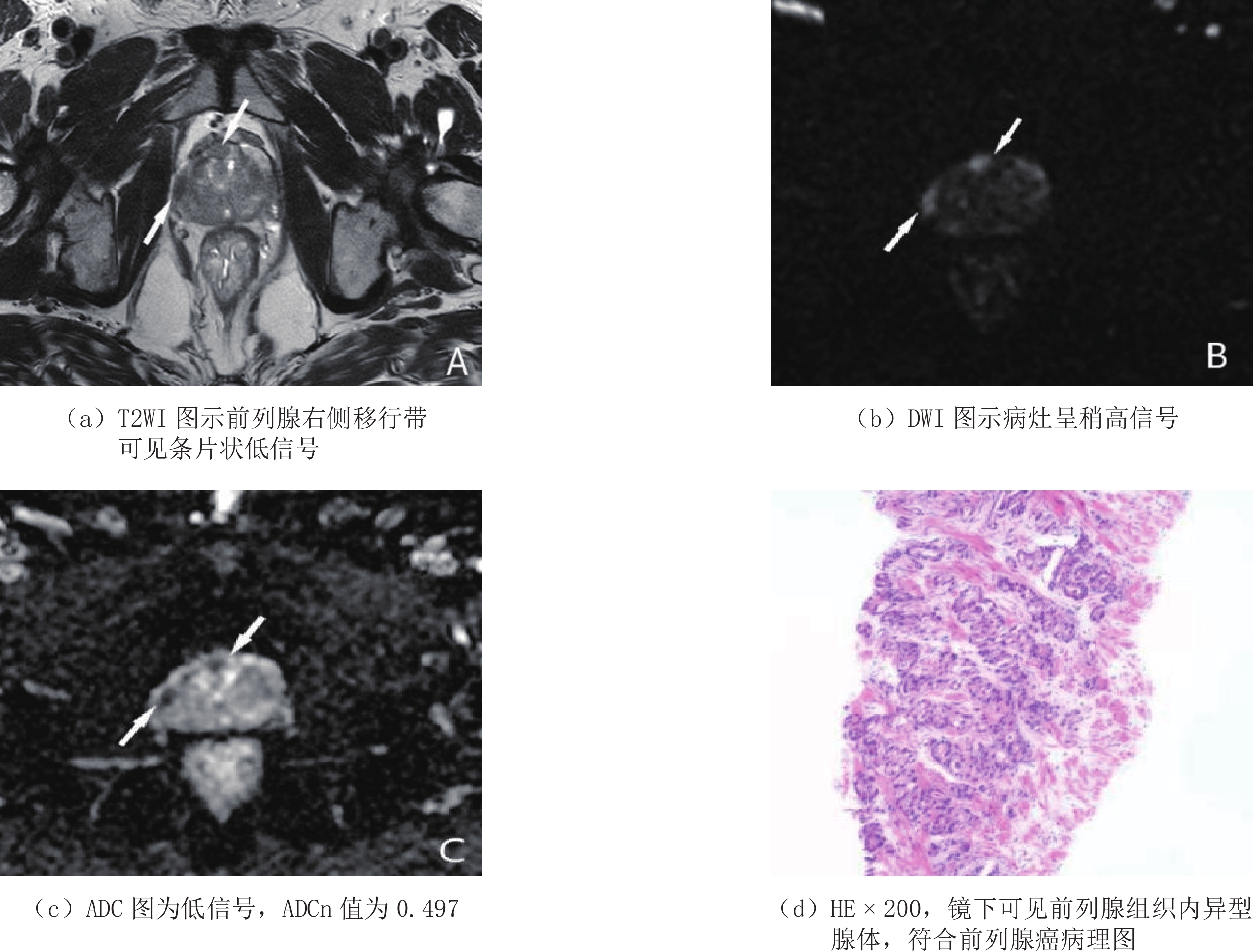
分别绘制ADCn、PSAD单独及联合使用诊断PCa的ROC曲线(图1),并进行分析。当ADCn取最佳诊断阈值0.588时,AUC、敏感度、特异度为0.849(95%CI 0.730~0.929)、85.2%、81.6%;PSAD取最佳诊断阈值0.211 ng/mL·cm3时,AUC、敏感度、特异度为0.813(95%CI 0.688~0.903)、85.0%、78.4%,两者间AUC差异无统计学意义。ADCn+PSAD联合使用,最佳诊断阈值为0.373,诊断PCa的敏感度、特异度为90.0%和89.5%,AUC达到了0.962(95%CI 0.876~0.995),高于两者单独使用,且差异具有统计学意义(表3和表4)。ADCn、PSAD对两例PI-RADS v2.1评分3分病灶的诊断与病理结果对照(图2和图3)。
表 3 ADCn、PSAD及两者联合的灵敏度、特异度、最佳阈值及AUC的比较Table 3. Comparison of sensitivity, specificity, optimal threshold, and area under the AUC of ADCn, PSAD, and their combination观察变量 AUC 95%CI 灵敏度/% 特异度/% 约登指数 阈值 标准误差 P ADCn 0.849 0.730,0.929 85.2 81.6 0.666 0.588 0.051 <0.001 PSAD 0.813 0.688,0.903 85.0 78.4 0.534 0.211 0.055 <0.001 ADCn+PSAD 0.962 0.876,0.995 90.0 89.5 0.795 0.373 0.021 <0.001 表 4 ADCn、PSAD及两者联合的受试者工作特征曲线(ROC)比较Table 4. Comparison of ROCs of ADCn, PSAD, and their combination观察变量 ADCn PSAD ADCn+PSAD ADCn − 0.664/0.434 0.012/2.524 PSAD 0.664/0.434 − 0.004/2.863 ADCn+PSAD 0.012/2.524 0.004/2.863 − 注:表中数字为不同变量之间ROC比较P/Z的结果,前者为P值,后者为Z值。如0.012/2.524即为ADCn与ADCn+PSAD之间的AUC比较,P值为0.012,Z值为2.524。 3. 讨论
2019年PI-RADS委员会发布了多参数MRI的前列腺影像报告和数据系统版本2.1(prostate imaging reporting and data system,version 2.1,PI-RADS V2.1),对PI-RADS v2.0版的评分细则进行了修改,提高了敏感性和特异性,被诸多研究者用于前列腺癌的检测和危险分层[8-9]。
PI-RADS v2.1认为1~2分病灶患癌的可能性极低,建议随访观察;4~5分病灶则建议穿刺活检,以达到尽早的明确诊断。然而,对于3分病灶的良恶性判定仍然存在不确定性,并没有给出明确的指导意见,临床决策进退两难。PI-RADS v2.1评分为3分的病灶影像学表现多不典型,往往是在排除了其他评分后归为此类,国内外学者对于此类病灶中csPCa的检出率的报道也不尽相同。
Osses等[10]研究认为,PI-RADS 3分病灶的穿刺阳性率为32%,其中23% 为临床有意义PCa(clinically significant PCa,csPCa)。Schlenker等[11]研究发现,PI-RADS 3分病灶PCa及csPCa穿刺阳性率分别为26.8% 和14.6%。这也就提示我们,若对PI-RADS 3分病灶均采取穿刺活检,虽可避免一部分漏诊,但带来的是阳性率较低,以及穿刺后出血、感染等并发症的风险。因此,目前对于PI-RADS 3分尤其是处于PSA灰区的患者,如何发掘更多有应用潜力的鉴别诊断指标,减少过渡诊断和治疗,将会是临床持续关注的热点。
MRI扩散加权成像(diffusion weighted imaging,DWI)是目前唯一能够无创性反映活体组织水分子扩散情况的功能性成像技术手段,可以通过测量ADC值对肿瘤组织微观结构变化进行量化评估,消除了T2透射效应影响,从而反映组织或病变性质。
前列腺癌时,由于组织细胞异质性造成细胞排列紧密,细胞外间隙扭曲、变形,间质成分减少,水分子扩散受限,在DWI图像表现为高信号,其ADC值减低。而良性的前列腺增生结节多由丰富的肥大腺体细胞和间质组成,并且细胞分化良好,水分子自由扩散不受限,DWI图像多呈等或低信号,与正常前列腺信号差异并不明显。
根据v2.1的标准,PI-RADS评分3分的病灶定义为ADC图表现为显著低信号或高b值的 DWI上表现为显著高信号,二者不能兼有;T2WI上表现为边界不清、不均匀低信号区亦或边界不清、信号不均的结节。我们分析入组的PI-RADS 3分诊断为PCa患者的MRI参数特征,认为对于DWI表现出来的高信号需要结合ADC值综合考虑分析,对病灶给与定性诊断。已有研究证实,PCa患者在MRI图像中具有更高的DWI信号和更低的ADC值[12]。
前列腺的ADC值容易受MRI设备、场强、b值选择以及年龄和种族的影响[13],前列腺炎、前列腺增生等疾病状态的生理变化也使其产生偏差,因此需要一个相对标准化的指标来平衡绝对ADC值的差异性。Hermie等[14]研究认为,前列腺癌与对侧正常组织ADC比值具备预测PI-RADS 3分csPCa的潜力,敏感性为59%,特异性为88%。我们认为其选择对侧正常的前列腺组织作为参考是有困难的,因为前列腺增生结节在ADC图像上亦可表现为不均匀信号或者稍低信号,会给测量结果带来不确定性,又由于前列腺增生常发生于中央腺体区,因此我们决定选择外周带正常前列腺组织作为参考较为妥当(即ADCn=ADC病灶/ADC外周带)。
本研究结果显示,PI-RADS 3分病灶中前列腺癌组的ADCn小于非前列腺癌组,差异具有统计学意义,当取最佳诊断阈值利用0.588时,绘制的ROC曲线下面积AUC达到0.849,敏感度85.2% 和特异度为81.6%,显示出了较高的预测价值。这也说明ADCn在一定程度上消除了个体差异影响,能够更加真实的量化PI-RADS 3分病灶组织扩散程度,纠正不同疾病组织ADC值的重叠影响,增加不同个体间的可比性。
PSA作为PCa重要的筛查标志物,当大于10 ng/mL时常提示患癌风险,由于其具有器官特异性而非肿瘤特异性的特点,表现出来的敏感性和特异性并不满意。临床中一部分患者PSA处于“灰区”,即4~10 ng/mL时,很难通过检验指标鉴别PCa和BPH,从而避免不必要的穿刺活检[15]。PSAD作为校正后的检测参数,体现了PSA与前列腺体积之间的相关性,纠正了病灶体积对PSA的影响,对PCa具有较高的诊断价值,也被认为是PSA灰区较为理想的参考指标。Song等[16]研究认为,PSAD对预测PSA灰区PCa表现出了较高的应用价值,同时对于PI-RADS 3分患者的临床决策也具有良好的参考意义[17]。
本文将PSAD纳入研究中,结果显示PCa组的PSAD值明显高于非PCa组(0.28 ng/mL·cm3 vs. 0.18 ng/mL·cm3),这也提示在PSA灰区PI-RADS 3分病灶中PSAD值越高,患癌的风险越大,其诊断PCa的AUC为0.813,敏感度、特异度分别为85%和78.4%,其中特异度略低于国内学者吴静等[18]的研究结果(81.6%),分析原因可能为本研究纳入的患者PSA水平均位于4~10 ng/mL区间,PCa患病率相对较低,且样本量小容易放大个体化差异,一定程度上降低PSAD的诊断特异性,后续研究将会加大样本量进一步验证。有学者研究认为,PSAD能够提高PI-RADS 3分病灶PCa的检出率,建议最佳诊断阈值为0.15 ng/mL·cm3,低于本研究结果0.211 ng/mL·cm3。我们认为原因可能在于该研究组前列腺体积较大,以及就医不及时、PCa分期晚等造成PSA值偏高等有关[19]。
本研究结果提示,ADCn、PSAD对PI-RADS 3分病灶中PCa的检出具有较好的作用。目前,临床上为减少模棱两可的诊断结果,建议不应单一的采取某特定的标准,推荐应用多指标联合进行全面系统评估。本研究联合应用ADCn与PSAD,诊断的敏感度和特异度为90.0%和89.5%,均优于单一指标,其AUC更是达到了0.962,具有明显的优越性。我们认为,对于PSA灰区PI-RADS 3分病灶,联合应用ADCn和PSAD可以有效提高PCa的预测能力,可大幅提高诊断准确性,避免不必要的穿刺活检和过度治疗,具有极高的参考和应用价值。
本研究存在的不足:①本研究为回顾性分析设计,存在一定的选择偏倚风险;②本研究的入组样本量较少,可能会降低预测价值,后期需要增加样本量进一步论证;③本研究部分病理结果来自穿刺活检,同样存在漏诊风险。
综上所述,在对PSA灰区PI-RADS 3分病灶的临床决策仍然存在困难,单纯依靠常规影像学表现来诊断PCa是有局限性的,ADCn、PSAD可以有效提高对于此类患者的患癌风险评估,两者联合鉴别诊断效果达到了很好的水平,为术前无创性准确检出PCa提供了新的方法,值得临床推广应用。
-
表 1 前列腺MRI扫描具体参数
Table 1 Specific parameters of prostate MRI scans
扫描序列 TR/ms TE/ms Fov/mm 层厚/mm 矩阵 层间距/mm 横断位T1WI 850 20 250×220 4 224×380 1 横断位T2WI 4000 110 250×220 4 224×380 1 矢状位T2WI 3000 110 240×220 4 240×160 1 横断位DWI 6000 76 290×240 4 128×128 1 DCE-MRI 5.28 1.35 220×220 4 240×330 1 表 2 各变量在PCa组和非PCa组间差异比较
Table 2 Comparison of the differences in variables between the PCa and non-PCA groups
项目 组别 统计检验 PCa组 非PCa组 t/Z P 例数 20 38 − − 年龄/岁 67.60±10.78 67.84±7.37 -0.101 0.021 PSA/(ng/mL) 7.15±2.17 6.39±1.75 1.45 0.052 PSAD/(ng/mL·cm3) 0.28(0.23,0.31) 0.18(0.14,0.24) -3.89 <0.001 ADCn 0.52(0.47,0.57) 0.69(0.64,0.78) -4.36 <0.001 注:表中括号内数字为第 25 百分位数和第 75 百分位数。 表 3 ADCn、PSAD及两者联合的灵敏度、特异度、最佳阈值及AUC的比较
Table 3 Comparison of sensitivity, specificity, optimal threshold, and area under the AUC of ADCn, PSAD, and their combination
观察变量 AUC 95%CI 灵敏度/% 特异度/% 约登指数 阈值 标准误差 P ADCn 0.849 0.730,0.929 85.2 81.6 0.666 0.588 0.051 <0.001 PSAD 0.813 0.688,0.903 85.0 78.4 0.534 0.211 0.055 <0.001 ADCn+PSAD 0.962 0.876,0.995 90.0 89.5 0.795 0.373 0.021 <0.001 表 4 ADCn、PSAD及两者联合的受试者工作特征曲线(ROC)比较
Table 4 Comparison of ROCs of ADCn, PSAD, and their combination
观察变量 ADCn PSAD ADCn+PSAD ADCn − 0.664/0.434 0.012/2.524 PSAD 0.664/0.434 − 0.004/2.863 ADCn+PSAD 0.012/2.524 0.004/2.863 − 注:表中数字为不同变量之间ROC比较P/Z的结果,前者为P值,后者为Z值。如0.012/2.524即为ADCn与ADCn+PSAD之间的AUC比较,P值为0.012,Z值为2.524。 -
[1] TEOH J Y C, HIRAI H W, HO J M W, et al. Global incidence of prostate cancer in developing and developed countries with changing age structures[J]. PLoS One, 2019, 14(10): e0221775. doi: 10.1371/journal.pone.0221775
[2] CHEN R, HUANG Y, CAI X, et al. Age-specific cutoff value for the application of percent free prostate-specific antigen (PSA) in Chinese men with serum PSA levels of 4.0~10.0 ng/ml[J]. PLoS One, 2015, 10(6): e0130308. doi: 10.1371/journal.pone.0130308
[3] 汪洋, 宦怡, 任静. 前列腺影像报告与数据系统2.1版(PI-RADS v2.1): 解读与比较[J]. 国际医学放射学杂志, 2019,42(6): 712−716. WANG Y, HUAN Y, REN J. Interpretation of prostate imaging-reporting and data system version 2.1 (PI-RADS v2.1) and comparison with version 2.0[J]. International Journal of Medical Radiology, 2019, 42(6): 712−716. (in Chinese).
[4] KASIVISVANATHAN V, RANNIKKO, A S, BORGHI M, et al. MRI-Targeted or standard biopsy for prostate-cancer diagnosis[J]. The New England Journal of Medicine, 2018, 378(19): 1767−1777. doi: 10.1056/NEJMoa1801993
[5] KIM T J, LEE M S, HWANG S I, et al. Outcomes of magnetic resonance imaging fusion-targeted biopsy of prostate imaging reporting and data system 3 lesions[J]. World Journal of Urology, 2018, 37(8): 1581−1586.
[6] BARRETT T, PRIEST A N, LAWRENCE E M, et al. Ratio of tumor to normal prostate tissue apparent diffusion coefficient as a method for quantifying DWI of the prostate[J]. American Journal of Roentgenology, 2015, 205(6): W585−W593. doi: 10.2214/AJR.15.14338
[7] WEINREB J C, BARENTSZ J O, CHOYKE P L, et al. PI-RADS prostate imaging-reporting and data system: 2015, Version 2[J]. European Urology, 2016, 69(1): 16−40. doi: 10.1016/j.eururo.2015.08.052
[8] TURKBEY B, ROSENKRANTZ A B, HAIDER M A, et al. Prostate imaging reporting and data system version 2.1: 2019 update of prostate imaging reporting and data system version 2[J]. European Urology, 2019, 76(3): 340−351. doi: 10.1016/j.eururo.2019.02.033
[9] PADHANI A R, BARENTSZ J, VILLEIRS G, et al. PI-RADS steering committee: The PI-RADS multiparametric MRI and MRI-directed biopsy pathway[J]. Radiology, 2019, 292(2): 182946.
[10] OSSES D F, ARSOV C, SCHIMMLLER L, et al. Equivocal PI-RADS three lesions on prostate magnetic resonance imaging: Risk stratification strategies to avoid MRI-Targeted biopsies[J]. Journal of Personalized Medicine, 2020, 10(4): 270. doi: 10.3390/jpm10040270
[11] SCHLENKER B, APFELBECK M, ARMBRUSTER M, et al. Comparison of PIRADS 3 lesions with histopathological findings after MRI-fusion targeted biopsy of the prostate in a real world-setting[J]. Clinical Hemorheology and Microcirculation, 2019, 71(2): 165−170. doi: 10.3233/CH-189407
[12] VSAB C, TSA D, YHAEF G, et al. False positive multiparametric magnetic resonance imaging phenotypes in the biopsy-nave prostate: Are they distinct from significant cancer-associated lesions? Lessons from PROMIS[J]. European Urology, 2021, 79(1): 20−29. doi: 10.1016/j.eururo.2020.09.043
[13] TAMADA T, PRABHU V, LI J, et al. Assessment of prostate cancer aggressiveness using apparent diffusion coefficient values: Impact of patient race and age[J]. Abdominal Radiology, 2017, 42(6): 1744−1751. doi: 10.1007/s00261-017-1058-y
[14] HERMIE, BESIEN I, VISSCHERE J, et al. Which clinical and radiological characteristics can predict clinically significant prostate cancer in PI-RADS 3 lesions? A retrospective study in a high-volume academic center[J]. European Journal of Radiology, 2019, 11492-11498.
[15] NAN L B, YIN X T, GAO J P. Significant diagnostic value of free-serum PSA (FPSA)/prostate-specific antigen density (PSAD) and (F/T)/PSAD for prostate cancer of the Chinese population in a single institution[J]. Medical Science Monitor: International Medical Journal of Experimental and Clinical Research, 2019, 25: 8345−8351.
[16] SONG Z J, QIAN J K, YANG Y, et al. PSA density in the diagnosis of prostate cancer in the Chinese population: Results from the Chinese prostate cancer consortium[J]. Asian Journal of Andrology, 2021, 23(3): 300−305. doi: 10.4103/aja.aja_61_20
[17] FELKER, E R, RAMAN S S. Risk stratification among men with prostate imaging reporting and data system version 2 category 3 transition zone lesions: Is biopsy always necessary?[J]. American Journal of Roentgenology, 2017, 209(6): 1272−1277. doi: 10.2214/AJR.17.18008
[18] 吴静, 汪贤云, 田晓燕, 等. 前列腺特异性抗原密度在PI-RADS v2评分3分患者中的应用价值[J]. 实用放射学杂志, 2021,37(2): 271−274. doi: 10.3969/j.issn.1002-1671.2021.02.024 WU J, WANG X Y, TIAN X Y, et al. Application value of prostate-specific antigen density in the lesion with category 3 of PI-RADS v2[J]. Journal of Practical Radiology, 2021, 37(2): 271−274. (in Chinese). doi: 10.3969/j.issn.1002-1671.2021.02.024
[19] 陈志远, 张艳, 周懂晶, 等. 前列腺特异性抗原密度在前列腺影像报告和数据系统第二版评分为3分患者临床决策中的应用[J]. 中国医学影像技术, 2018,34(6): 906−910. CHEN Z Y, ZHANG Y, ZHOU D J, et al. Value of prostate specific antigen density in clinical decision-making for prostate imaging reporting and data system v2 category 3 lesions[J]. Chinese Journal of Medical Imaging Technology, 2018, 34(6): 906−910. (in Chinese).



 下载:
下载: