Prediction of WHO/ISUP Grading of Renal Clear Cell Carcinoma by Quantitative Parameters of CT Enhancement Scanning
-
摘要:
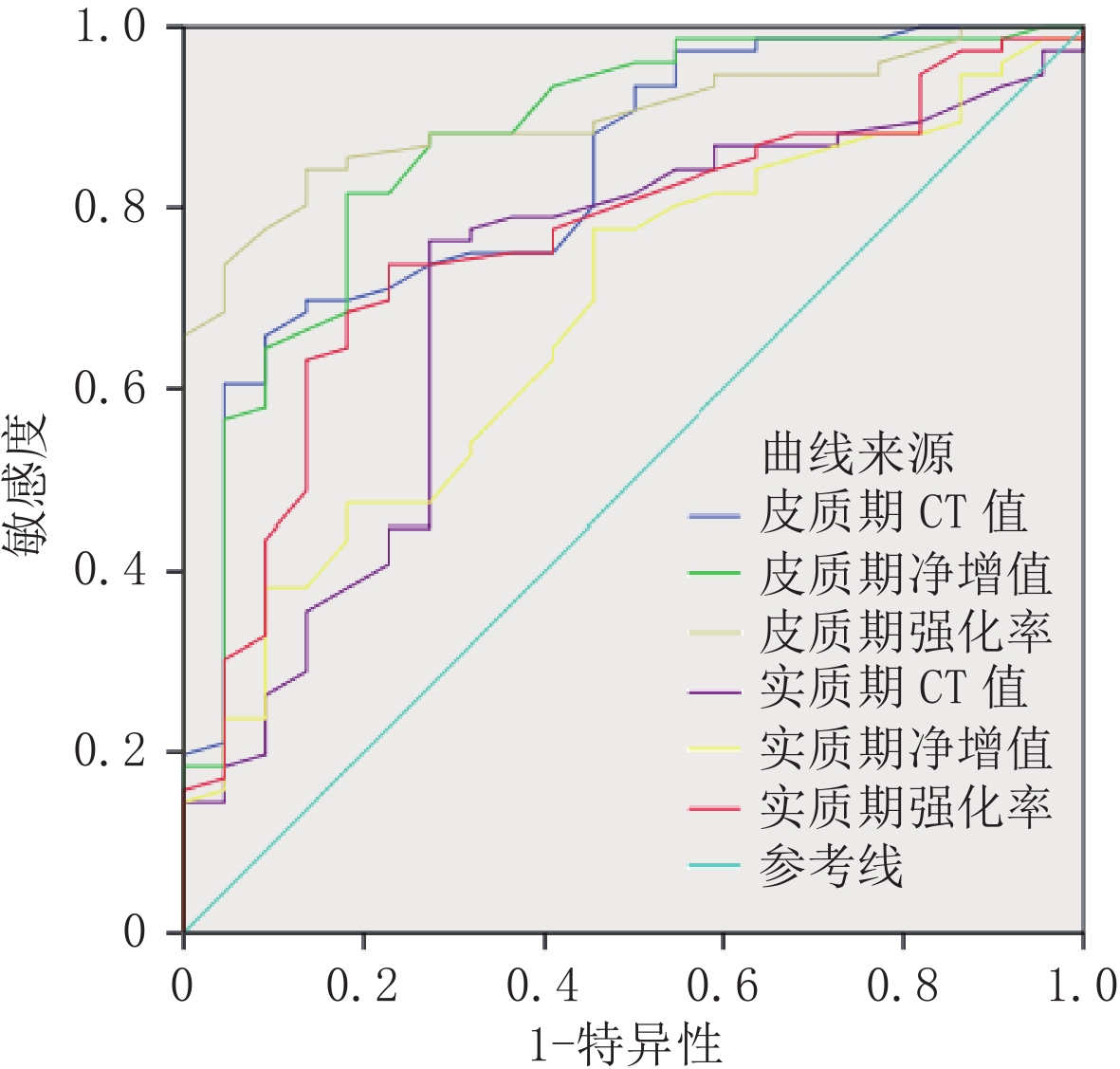
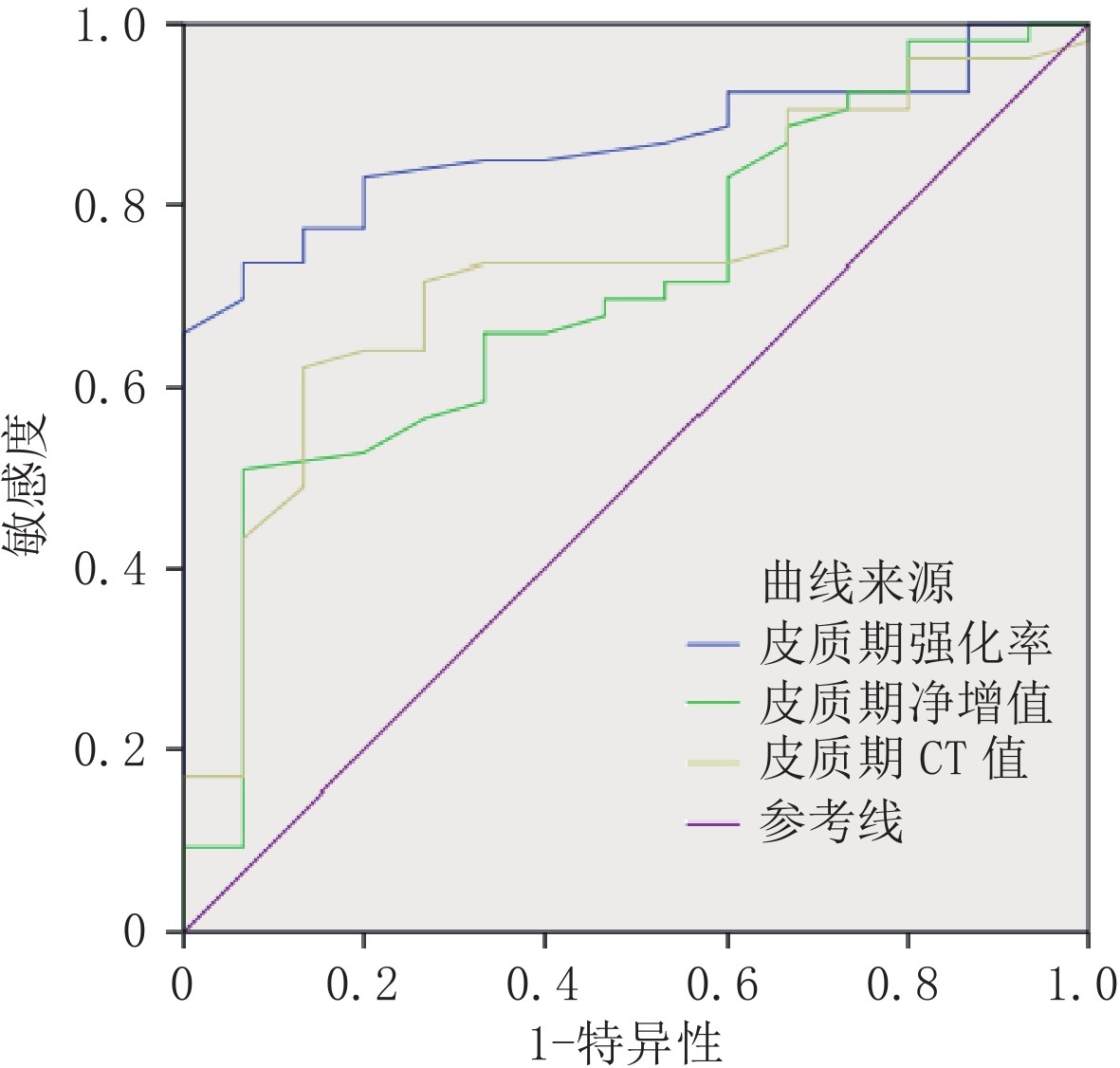
目的:探讨CT增强定量参数术前预测肾透明细胞癌(ccRCC)世界卫生组织/国际泌尿病理学会(WHO/ISUP)分级的价值。方法:连续搜集行手术治疗的98例ccRCC患者临床和CT增强资料,根据WHO/ISUP分级分为低级别组(76例)和高级别组(22例)。比较CT增强定量参数两组间差异及各参数预测ccRCC WHO/ISUP分级的诊断效能,并进行外部验证,找寻泛化能力最佳的CT增强定量参数。结果:两组间皮质期CT值、皮质期净增值、皮质期强化率、实质期CT值、实质期净增值、实质期强化率差异均有统计学意义,AUC值分别依次为0.834、0.871、0.900、0.707、0.678和0.762;截断值分别依次为123.5 HU、71 HU、0.73、87.5 HU、54 HU、0.67;皮质期强化率诊断效能最高,AUC=0.900,敏感度为0.842,特异度为0.864;外部验证结果显示皮质期强化率诊断效能(AUC=0.867)优于皮质期CT值(AUC=0.735)、皮质期净增值(AUC=0.709),Z值分别为 2.134和2.417。结论:CT增强定量参数可用于预测ccRCC WHO/ISUP分级,皮质期强化率是诊断效能最高、泛化能力最佳的CT增强定量参数。
Abstract:Objective: To investigate the potential of CT-enhanced quantitative parameters for preoperative prediction of WHO/ISUP grading for renal clear cell carcinoma (ccRCC). Methods: The study involved collecting clinical and CT-enhanced data of 98 patients with ccRCC, who were then classified into low level group (76 cases) and high level group (22 cases) based on the WHO/ISUP classification. Differences in CT-enhanced quantitative parameters between the two groups were compared, and the diagnostic efficacy of each parameter for predicting ccRCC WHO/ISUP grading was evaluated. External verification was conducted to identify CT-enhanced quantitative parameters with the best generalization ability. Results: There were significant differences in the CT value, net increment, and enhancement rate in both cortical and substantive phases between the two groups. The AUC values were 0.834, 0.871, 0.900, 0.707, 0.678, and 0.762, respectively. The cut-off values were 123.5 HU, 71 HU, 0.73, 87.5 HU, 54 HU, 0.67, respectively. The diagnostic efficacy of cortical enhancement rate was the highest with an AUC of 0.900, a sensitivity of 0.842, and a specificity of 0.864. The external validation results revealed that the diagnostic efficacy of cortical phase enhancement rate (AUC=0.867) was better than that of cortical phase CT (AUC=0.735) and cortical phase net increment (AUC=0.709). The Z values were 2.134 and 2.417, respectively. Conclusion: The quantitative parameters of CT enhancement can be used to predict ccRCC WHO/ISUP grading. Cortical phase enhancement rate is the parameter with the highest diagnostic efficiency and the best generalization ability.
-
Keywords:
- tomography /
- X-ray computer /
- clear cell renal carcinoma /
- pathological grading
-
原发性小肠淋巴管扩张症(primary intestinal lymphangiectasia,PIL)是一种小肠黏膜和黏膜下多发淋巴管扩张,导致蛋白由肠黏膜丢失,从而出现低白蛋白血症、低淋巴细胞血症和低免疫球蛋白血症的一种罕见的蛋白丢失性肠病,其发病原因不明[1-4]。病理学上,PIL表现为小肠黏膜和黏膜下多发迂曲扩张的淋巴管[5-6]。PIL患者的主要临床症状为乏力、腹痛、体重减轻,甚至部分患者出现脂肪泻,主要体征为肢体肿胀、腹泻和浆膜腔积液[1-3,6-10]。由于PIL缺乏特异性症状,且与其它消化系统疾病、营养不良性疾病的症状相似,故常常导致漏诊或误诊。PIL的确诊依据是内镜下的组织病理学检查,然而该检查是侵入性的,且只能评价小肠肠壁粘膜局部病变[11-13],而对于腹腔内是否存在异常扩张淋巴管,以及该异常淋巴管的部位、范围和分布则不能评价[6,13-14],这不利于PIL疾病的精准诊断,更不利于合理治疗方式的选择。
淋巴循环影像学是近年来的研究热点[15-18]。既往研究表明,直接淋巴管造影可动态评价淋巴循环的整体情况,CT淋巴管成像(CT lymphangiography,CTL)与内镜相结合,则可对PIL的小肠、肠系膜以及机体其它部位淋巴循环的异常进行综合评价[16,18-21]。然而,对于PIL的分型和分类尚无明确报道研究,这不利于对发病机制的探讨和治疗方式的选择。
因此,本研究通过回顾性分析首都医科大学附属北京世纪坛医院PIL的临床和影像学资料,基于CTL特征性影像学征象首次提出PIL的影像学分型方法,基于此分型比较不同类型PIL的影像和临床征象的差异,用于进一步探讨PIL的发病机制,选择合理化的治疗方式。
1. 资料与方法
1.1 一般资料
本研究通过医院伦理委员会批准,回顾性分析2016年1月至2019年12月入我中心确诊为PIL进行诊疗的患者。
入组标准:①以反复发作的肢体肿胀、低蛋白血症、腹泻等为主要表现,经内镜下和病理组织证实为PIL的患者;②入院后 1月内行CTL和核素淋巴管显像者;③既往未经手术和侵入性操作破坏淋巴循环的患者。排除标准:①小肠原发病变,如结核、炎症性肠病、结缔组织病、系统性红斑狼疮等自身免疫性肠病等;②各种原因导致的低蛋白血症,包括:营养不良性、蛋白合成功能障碍性、肾脏和/或其它部位蛋白丢失导致的低蛋白血症;③继发性淋巴循环异常,如肿瘤、手术、外伤、放化疗等导致患者淋巴循环异常者;④未行肠镜和 CTL检查者。
1.2 CTL成像
CTL的检查步骤[16,18-19]。①浅表淋巴管的标记与染色:患者取仰卧位,将无肿胀或肿胀程度较轻侧的肢体的双足暴露,取染色剂2 mL(利多卡因与亚甲蓝混合液,比例1︰1),注射于第1和第2足趾间皮下及皮内组织,观察局部淋巴管染色标记成功;②浅表淋巴管的穿刺:显微镜下由淋巴外科医师穿刺已染色的淋巴管,注入大分子对比剂碘化油(Lipiodol UF,Guerbet公司),总量约8~20 mL,流率4~6 mL/h;③动态观察淋巴循环过程:在DSA间断动态记录整个淋巴循环的回流过程,即记录对比剂由起点至终点的全过程(足淋巴管至胸导管末端),观察对比剂由胸导管末端回流入血的情况;④CTL:观察对比剂由胸导管末端入血后的20 min至2 h内,对患者行CT检查,扫描范围从颈部至盆腔,扫描参数:80~120 kVp,100~120 mAs,重建层厚2 mm,间隔1.8 mm。所有图像经过后处理重建,横断面、冠状面、矢状面和MIP等多角度观察,最终得出整体淋巴循环的评价。
1.3 影像学评价与分型
所有CTL图像由两名医师(副主任医师,工作14年和17年)分别阅片。评价内容:①小肠病变,包括肠壁环状增厚和肠系膜密度增高,其中肠壁厚度≥3 mm为增厚,肠系膜密度增高定义为与相应节段无水肿的皮下脂肪密度相比,CT值提高20 HU以上,且所取测量区域无浆膜腔积液表现;②浆膜腔积液,包括胸腔、腹腔及心包积液;③异常淋巴管分布的部位与范围,是指小肠肠壁、肠系膜、腹膜后、结肠、直肠和/或实质脏器等出现异常分布的不规则线条状、团片状、簇状对比剂,提示局部存在异常扩张的淋巴管;④淋巴返流,是指对比剂沿扩张淋巴管由乳糜池、腰干返流至注射对侧的淋巴管,主要表现为双侧盆腔及髂血管旁多发对比剂;⑤淋巴瘘,表现为对比剂分布于肠管内和/或腹盆腔内,提示淋巴液没有回流入正常的淋巴循环,而随着局部瘘口流入肠腔和/或浆膜腔;⑥淋巴结,腹腔、肠系膜、盆腔内出现短径大于1 cm的淋巴结;⑦颈部异常对比剂分布,表现为颈部、腋下出现多发异常对比剂分布,部分甚至出现潴留样改变[18-19]。
基于对比剂是否出现于小肠肠壁和/或肠系膜这一特异性征象,本组将PIL分为Ⅰ型(CTL阳性组)与Ⅱ型(CTL阴性组)。当出现评价结果不一致时,由两名医师再次共同读片,达成一致后,记录最终评价结果。
1.4 统计结果分析
分别比较两组PIL患者的临床资料与影像征象,包括年龄、性别、首次发病年龄、临床症状与体征、白蛋白等,影像征象比较包括肠壁增厚、肠系膜密度增高、浆膜腔积液、异常淋巴管分布的部位范围、淋巴返流、淋巴瘘、腹腔内淋巴结和颈部异常对比剂分布。定量资料采用独立样本t检验,计数资料采用卡方检验,取P<0.05具有统计学意义。
2. 结果
2.1 临床资料分析
本研究最终入组PIL患者共34例(女/男,17/17例,年龄范围1~27岁,平均年龄(11.4±7.7)岁。主要临床表现为不同程度的腹泻,下肢和/或全身淋巴水肿及低蛋白血症,其中Ⅰ型15例,Ⅱ型19例。Ⅰ型患者的首次发病年龄高于Ⅱ型(15.3±9.4 vs. 8.3±3.8),临床症状中腹泻的发生率高于Ⅱ型,而肢体和/或颜面部肿胀的比例低于Ⅱ型,其性别比与血清白蛋白含量(g/L)则无明显差异。两组PIL临床特征的比较分析见表1。
表 1 不同类型PIL的临床特征比较分析Table 1. Comparison of clinical characteristics in different types of PIL临床特征 类型 统计检验 Ⅰ型(n=15) Ⅱ型(n=19) t/χ2 P 首次发病年龄 15.3±9.4 8.3±3.8 2.995 <0.010 性别比(女/男) 7/8 10/9 0.119 0.730 腹泻 11(73.3%) 6(31.6%) 5.846 0.016 颜面和/或肢体肿胀 8(53.3%) 19(100%) 11.165 <0.010 血清白蛋白/(g/L) 17.1±4.4 18.6±6.3 -0.935 0.357 2.2 影像特点的比较分析
Ⅰ型PIL对比剂异常分布主要位于十二指肠、空肠和回肠,8例患者病变广泛,表现为腹腔内腹膜、肠系膜、多组小肠、结肠均出现异常分布对比剂(图1)。Ⅱ型PIL主要影像学征象为肠壁增厚、肠系膜弥漫密度增高、且肠系膜和肠壁没有对比剂分布(图2)。两组PIL影像征象的比较结果见表2,结果表明:Ⅰ型出现腹膜后淋巴管扩张和淋巴瘘的比例高于Ⅱ型,而出现肠系膜密度增高和腹腔淋巴结的比例明显低于Ⅱ型。两组患者在小肠壁增厚、浆膜腔积液、返流样表现(图2)和颈部异常扩张淋巴管(图3)方面的比例差异无统计学意义(表2)。
表 2 不同类型PIL的影像特征比较分析Table 2. Comparison of CTL imaging features in different types of PIL影像特征 类型 统计检验 Ⅰ型(n=15) Ⅱ型(n=19) χ2 P 小肠改变 肠壁环形增厚 2(13.3%) 1(5.3%) 0.679 0.410 肠系膜密度增高 7(46.7%) 18(94.7%) 9.952 0.002 浆膜腔积液 仅腹腔积液 1(6.7%) 3(15.8%) 0.672 0.412 腹腔+胸腔积液 1(6.7%) 4(21.1%) 1.383 0.240 返流样表现 8(53.3%) 7(36.8%) 0.925 0.336 淋巴瘘 5(33.3%) 0(0.0%) 7.425 0.006 腹腔内淋巴结 2(13.3%) 12(63.2%) 8.591 0.003 腹膜后淋巴管扩张 13(86.7%) 0 26.660 0.000 颈部扩张淋巴管 5(33.3%) 12(63.2%) 2.982 0.084 3. 讨论
PIL的典型临床症状与表现为腹泻、肢体肿胀与反复发作的低蛋白血症[5-6]。本研究结果表明,不同分型的PIL在临床症状、体征与典型实验室检查结果之间存在一定的差异。Ⅰ型患者首次就诊时通常为青少年,部分甚至成年后入院就诊方能诊断。Ⅱ型PIL患者的首次发病年龄更小,部分患者甚至在不满1岁即确诊。追溯原因可能为Ⅰ型患者常表现为不典型的腹泻,部分出现低蛋白血症,肢体肿胀常被低蛋白血症掩盖,临床症状缺乏特异性,容易与其他代谢类疾病及营养不良类疾病混淆,导致出现漏诊或误诊。Ⅱ型患者通常婴幼儿起病,且伴有肢体淋巴肿,可单侧,也可双侧,且常并发上肢、颜面部肿胀,部分甚至出现生长发育迟缓,容易被发现引起重视而及时就诊。
两组患者的性别比和白蛋白水平比较则无差异,提示两种不同类型的PIL并未表现出性别差异,该类患者需耐心追溯病史与症状,推断发病时间,从而得到明确诊断,进而采用合理化治疗方案早期干预。
CTL评价PIL中异常淋巴管部位、范围和程度的主要方式,是基于CT图像中对比剂分布的部位和范围[16-19]。主要依据是,本研究中采用显微镜下穿刺远端淋巴管,进而注射入大分子对比剂碘化油作为对比剂,该对比剂分子量很大,不能穿透淋巴管进入周围组织和血管。从而,对比剂所分布的区域,就是淋巴管和淋巴结所在的位置,因此可通过CTL成像,评价异常淋巴管的分布、走行和范围
本研究中,Ⅰ型患者对比剂异常分布,主要位于十二指肠、空肠和回肠,部分患者病变广泛,表现为腹腔内腹膜、肠系膜、多组小肠、结肠均出现异常扩张的淋巴管。主要CTL影像表现为腹腔多组小肠、结肠的肠壁和/或肠系膜,以及腹腔内的腹膜、肠系膜等相应部位出现散在多发点、片状对比剂,提示局部有扩张淋巴管(图1)。因此CTL可以对异常淋巴管扩张的部位和累及范围的进行评价,有利于患者有针对性的合理治疗方案的选择。
Ⅱ型PIL是本研究中的另一种分型,主要影像学征象为肠壁增厚、肠系膜弥漫密度增高、且肠系膜和肠壁没有对比剂分布(图2)。这表明该类患者淋巴循环中的对比剂到达腰干和乳糜池后,并没有沿肠干向肠系膜和小肠肠壁返流,而是继续上行经胸导管回流入血,提示肠干、肠系膜和小肠肠壁的淋巴液还可以继续向乳糜池回流,而内镜下该类患者同样表现为小肠粘膜和粘膜下的淋巴管扩张,提示该类患者可能主要病变位于小肠粘膜,而不是整体的淋巴循环。
因此,基于CTL对比剂是否出现于小肠肠壁和/或肠系膜的这一典型影像学征象,将PIL分为这两种类型,有利于PIL的精准评价,对探讨PIL的发病机制具有重要意义。此外,Ⅰ型与Ⅱ型出现该种差异的原因也可能与Ⅱ型患者年龄幼小,病程短,其它部位淋巴系统异常还未表现出来有关,进一步研究则需长时间随访予以证实。
CTL检查显示淋巴返流是淋巴循环动力学异常的主要征象,这是CTL成像机制决定的[16-19]。本研究中,CTL采用的是直接淋巴管造影,对比剂采用的是特殊对比剂碘化油,这种对比剂不能通过淋巴管的内膜,因此只能分布于淋巴循环系统内,将对比剂由足远端淋巴管缓慢推注,对比剂会沿着淋巴回流途径经下肢、盆腔、腰干、乳糜池、胸导管回流入静脉,DSA下动态观察可完成淋巴循环系统回流情况的整体评价。本研究中,共15例(44.1%)的患者出现返流征象,且Ⅰ型与Ⅱ型均可出现,差异无统计学意义,提示PIL患者较易出现淋巴循环动力学的异常,其具体发病机制尚需进一步研究。
颈部出现异常扩张淋巴管是PIL患者的另一影像表现[20-21]。颈部出现异常扩张淋巴管主要受两种因素影响:首先是胸导管出口是淋巴循环的终点,此处存在淋巴回流异常,如各种原因导致的胸导管出口梗阻,则淋巴循环内的对比剂回流入血的途径受阻,导致淋巴液逆流甚至返流入周围颈部淋巴管,随着病程的延长,胸导管出口旁的颈部淋巴管则多发扩张,形成颈部对比剂的异常分布;其次,患者可能存在广泛的淋巴循环发育异常,因而颈部也存在有多发扩张的淋巴管,导致局部出现对比剂的聚集。本研究结果表明,CTL I型与Ⅱ型出现颈部异常对比剂分布的差异虽无统计学意义,但Ⅱ型的比例明显较高,依靠目前的影像和临床分型,尚无法确定PIL出现该现象的病理生理机制,需进一步通过病理组织学检查予以确定。
两种类型PIL的其它影像学征象对比中,Ⅰ型出现腹膜后淋巴管扩张和淋巴瘘的比例高于Ⅱ型,推测原因为I型在肠系膜和肠壁内有多发扩张的淋巴管,该部分淋巴管内有大量淋巴液经下肢和淋巴循环返流入局部小肠和肠系膜,当患者局部淋巴管压力过大,或病变累及到小肠粘膜破坏淋巴管的完整性时,则易于出现淋巴液瘘出至肠腔和/或浆膜腔这种征象。Ⅱ型患者由于没有对比剂返流至肠干和小肠壁,因此不易出现淋巴肠腔瘘和淋巴浆膜腔瘘。此外,两组患者小肠壁增厚、浆膜腔积液出现的比例无统计学差异,推测是由于该两种征象缺乏特异性。
本研究存在一定的局限性。①本研究采用的影像诊断方法是 CTL,反映的是DSA下直接淋巴管造影术后对比剂分布的最终结果,属于静态评价,并不能反映整体淋巴循环的动态回流过程,要得到淋巴循环的完整评估,进一步研究需将DSA和CTL结合方能实现;②CTL属于有创性检查,对于年龄小的患者,尤其是幼儿,需进行全麻下操作,这需要儿科、麻醉科、显微外科、淋巴外科等多学科合作完成,这限制了其广泛应用和开展;③本研究为单中心回顾性研究,受样本量的影响,部分征象评价不全面,需进一步扩大样本研究。
总之,CTL可以评价PIL患者异常淋巴管分布的部位、范围和程度,本研究基于CTL特征首次提出的PIL影像分型,不同类型的PIL显示出不同的临床和影像特征,对进一步探讨此类淋巴循环异常类疾病的机制具有重要价值。
-
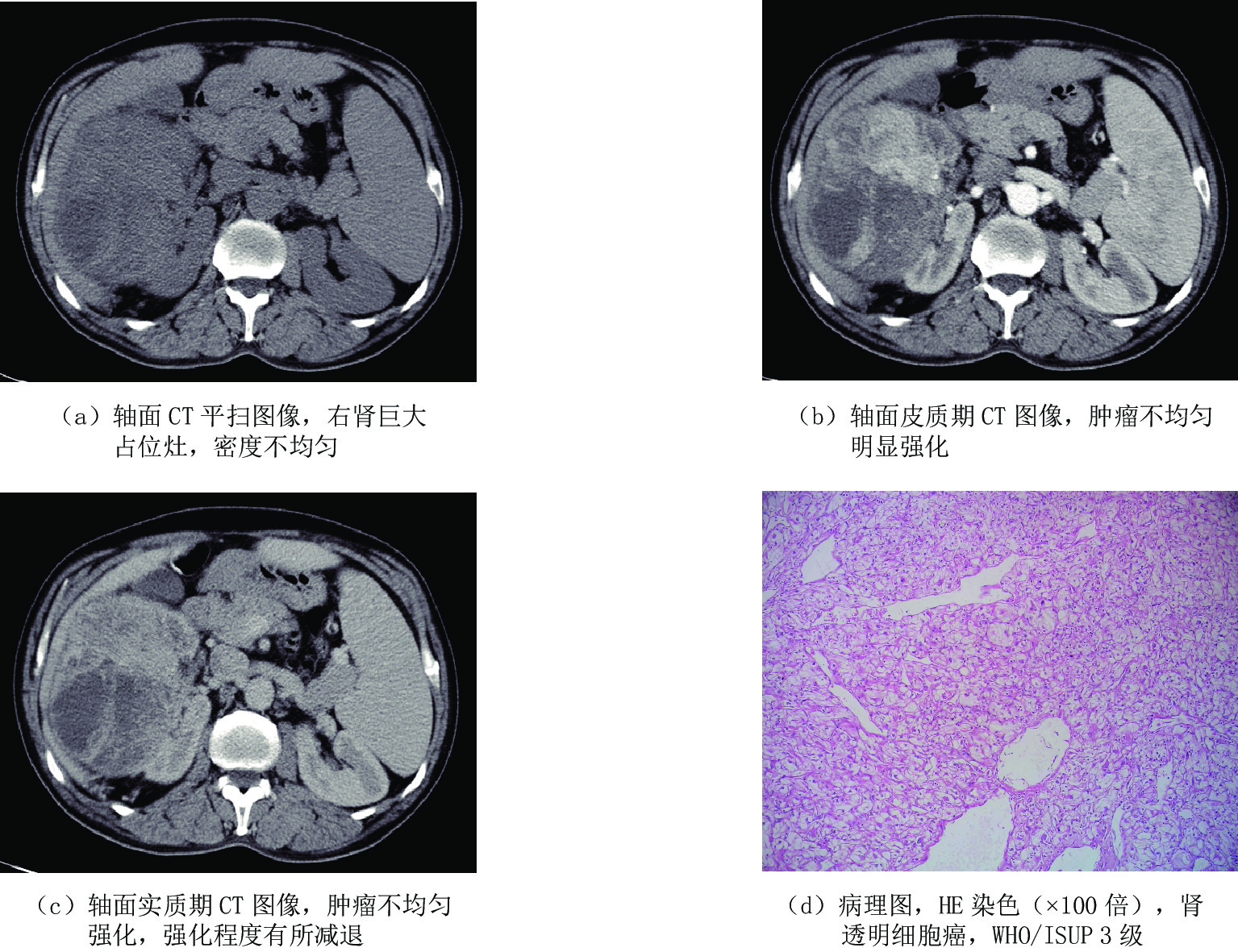
表 1 低级别组和高级别组肾透明细胞癌一般资料比较
Table 1 Comparison of general ccRCC characteristics between low- and high-grade groups
项目 组别 统计检验 低级别组(n=76) 高级别组(n=22) 统计量 P 年龄/岁 62.54±11.71 62.91±9.17 -0.136 0.892 性别(n(%)) 男性 44(57.89) 17(77.27) 2.726 0.099 女性 32(42.11) 5(22.73) 位置(n(%)) 左肾 46(60.53) 14(63.64) 0.070 0.792 右肾 30(39.47) 8(36.36) 表 2 低级别组和高级别组肾透明细胞癌CT增强定量参数比较
Table 2 Comparison of CT-enhanced quantitative parameters of ccRCC between the low- and high-level groups
CT增强定量参数 组别 统计检验 低级别组(n=76) 高级别组(n=22) t P 皮质期CT值 143.71±32.39 103.27±23.70 6.447 <0.001 皮质期净增值 98.24±27.32 61.86±19.64 6.954 <0.001 皮质期强化率 1.01±0.24 0.63±0.13 9.823 <0.001 实质期CT值 103.91±25.25 87.36±19.78 2.829 0.006 实质期净增值 68.26±22.43 54.64±15.79 2.661 0.009 实质期强化率 0.82±0.22 0.63±0.14 4.736 <0.001 表 3 肾透明细胞癌CT增强定量参数诊断效能
Table 3 Diagnostic efficacy of CT-enhanced quantitative parameters for ccRCC
CT增强定量参数 AUC 95%CI P 敏感度/% 特异度/% 皮质期CT值 0.834 0.741~0.927 <0.001 0.658 0.909 皮质期净增值 0.871 0.782~0.960 <0.001 0.816 0.818 皮质期强化率 0.900 0.840~0.959 <0.001 0.842 0.864 实质期CT值 0.707 0.582~0.832 0.003 0.763 0.727 实质期净增值 0.678 0.558~0.799 0.011 0.776 0.545 实质期强化率 0.762 0.655~0.868 <0.001 0.737 0.773 -
[1] SHEELA DEVI C S, SUCHITHA S, VEERENDRASAGAR R S. Evaluation of nuclear morphometry and ki-67 index in clear cell renal cell carcinomas: A five-year study[J]. Iranian Journal of Pathology, 2017, 12(2): 150−157. doi: 10.30699/ijp.2017.24873
[2] MOCH H, CUBILLA A L, HUMPHREY P A, et al. The 2016 WHO classification of tumours of the urinary system and male genital organs-part a: Renal, penile, and testicular tumours[J]. European Urology, 2016, 70(1): 93−105. doi: 10.1016/j.eururo.2016.02.029
[3] DELAHUNT B, EBLE J N, EGEVAD L, et al. Grading of renal cell carcinoma[J]. Histopathology, 2019, 74(1): 4−17. doi: 10.1111/his.13735
[4] 张涛, 汪建文, 陈立芳. 肾透明细胞癌多排螺旋CT影像表现与Fuhrman分级的相关性分析[J]. 安徽医药, 2020,24(6): 1192−1194. ZHANG T, WANG J W, CHEN L F. Correlation analysis of the relationship between MDCT feature and Fuhrman grading in 40 patients with clear cell renal cell carcinoma[J]. Anhui Medical and Pharmaceutical Journal, 2020, 24(6): 1192−1194. (in Chinese).
[5] ZHU Y H, WANG X, ZHANG J, et al. Low enhancement on multiphase contrast-enhanced CT images: An independent predictor of the presence of high tumor grade of clear cell renal cell carcinoma[J]. American Journal of Roentgenology, 2014, 203(3): 295−300. doi: 10.2214/AJR.13.12297
[6] 高杨, 陈炜越, 陈春妙, 等. 肾透明细胞癌的CT特征与其侵袭性的相关性研究[J]. 中国中西医结合影像学杂志, 2022,20(3): 250−254, 258. GAO Y, CHEN W Y, CHEN C M, et al. CT features of clear cell renal cell carcinoma and its correlation with the invasiveness[J]. Chinese Imaging Journal of Integrated Traditional and Western Medicine, 2022, 20(3): 250−254, 258. (in Chinese).
[7] DAGHER J, DELAHUNT B, RIOUX-LECLERCQ N, et al. Clear cell renal cell carcinoma: Validation of World Health Organization/International Society of Urological Pathology Grading[J]. Histopathology, 2017, 71(6): 918−925.
[8] 张庆林, 庄梅香, 罗雪萍. 增强CT参数在鉴别肾脏良恶性肿瘤中的初步研究[J]. 影像科学与光化学, 2021,39(6): 845−848. doi: 10.7517/issn.1674-0475.210505 ZHANG Q L, ZHUANG M X, LUO X P. Preliminary study of enhanced CT parameters in differential diagnosis of benign and malignant renal tumors[J]. Imaging Science and Photochemistry, 2021, 39(6): 845−848. (in Chinese). doi: 10.7517/issn.1674-0475.210505
[9] 陈天昱, 樊树峰. Fisher判别模型在肾透明细胞癌多层螺旋CT征像及病理学WHO/ISUP分级中的价值[J]. 浙江医学, 2021,43(7): 753−756, 774. doi: 10.12056/j.issn.1006-2785.2021.43.7.2020-2256 CHEN T Y, FAN S F. Establishment of a Fisher discriminant model for preoperative grading of renal clear cell carcinoma based on MSCT features and WHO/ISUP classification[J]. Zhejiang Medicine, 2021, 43(7): 753−756, 774. (in Chinese). doi: 10.12056/j.issn.1006-2785.2021.43.7.2020-2256
[10] 刘阳, 朱丽, 李建春, 等. 肾透明细胞癌WHO/ISUP分级的超声预测因素分析[J]. 中华医学超声杂志(电子版), 2021,18(6): 605−610. LIU Y, ZHU L, LI J C, et al. Ultrasonic predictors of WHO/ISUP classification of clear cell renal cell carcinoma[J]. Chinese Journal of Medical Ultrasound (Electronic Edition), 2021, 18(6): 605−610. (in Chinese).
[11] GAO J, XU Q, FU Y, et al. Comprehensive evaluation of 68 Ga-PSMA-11 PET/CT parameters for discriminating pathological characteristics in primary clear-cell renal cell carcinoma[J]. European Journal of Nuclear Medicine and Molecular Imaging, 2021, 48(2): 561−569. doi: 10.1007/s00259-020-04916-6
[12] WANG X, SONG G, JIANG H, et al. Can texture analysis based on single unenhanced CT accurately predict the WHO/ISUP grading of localized clear cell renal cell carcinoma?[J]. Abdominal Radiology, 2021, 46(9): 4289−4300. doi: 10.1007/s00261-021-03090-z
[13] 顾长青, 李陆, 孙冬雪, 等. 影像组学诺模图在术前预测肾透明细胞癌WHO/ISUP分级的应用研究[J]. 临床放射学杂志, 2022,41(10): 1915−1920. GU C Q, LI L, SUN D X, et al. Application of radiomic nomogram in preoperative prediction of WHO/ISUP grade of renal clear cell carcinoma[J]. Journal of Clinical Radiology, 2022, 41(10): 1915−1920. (in Chinese).
[14] MA Y, GUAN Z, LIANG H, et al. Predicting the WHO/ISUP grade of clear cell renal cell carcinoma through CT-based tumoral and peritumoral radiomics[J]. Front Oncol, 2022, 12: 831112.
[15] MAYER P, FRITZ F, KOELL M, et al. Assessment of tissue perfusion of pancreatic cancer as potential imaging biomarker by means of Intravoxel incoherent motion MRI and CT perfusion: Correlation with histological microvessel density as ground truth[J]. Cancer Imaging, 2021, 21(1): 13.
[16] SENGUPTA S, LOHSE C M, LEIBOVICH B C, et al. Histologic coagulative tumor necrosis as a prog-nostic indicator of renal cell carcinoma aggressiveness[J]. Cancer, 2005, 104(3): 511−520. doi: 10.1002/cncr.21206
[17] IANNESSI A, BEAUMONT H, HEBERT C, et al. Computer tomography-based body surface area evaluation for drug dosage: Quantitative radiology versus anthropomorphic evaluation[J]. The Public Library of Science, 2018, 13(2): e0192124.
[18] 赵文敬, 郭君武. 低浓度低剂量对比剂结合高注射流率在肠系膜上动脉CTA中的应用[J]. 中国中西医结合影像学杂志, 2020,18(1): 87−90. ZHAO W J, GUO J W. Application of a low dose of contrast media combined with high injection rate to superior mesenteric artery CTA[J]. Chinese Imaging Journal of Integrated Traditional and Western Medicine, 2020, 18(1): 87−90. (in Chinese).



 下载:
下载: